Oxid manganičitý (MnO2) Chemická štruktúra, vlastnosti a použitie
oxid manganičitý (MnO2) je anorganická chemická zlúčenina tvorená prvkom mangánu s oxidačným číslom +4 a kyslíkom, ktorý pri tvorbe oxidov má oxidačné číslo -2. Je tiež známy pod názvami oxidu manganičitého a anhydridu mangánu.
Je to pevná látka z tmavej až čiernej kávy. Je v prírode ako minerálny pirolusit, čierne a kryštalizujúce formujúce dendrity (rozvetvené predĺženia). Môže sa získať ako čierny zvyšok v reakcii medzi etylénom a manganistanom draselným po vytvorení glykolu oxidačným pôsobením manganistanu draselného..

Je veľmi dôležitý v sklárskom priemysle vďaka svojmu charakteru oxidačného činidla, pretože odstraňuje zelenú farbu pochádzajúcu zo železných zlúčenín a premieňa ich na železné kovy..
index
- 1 Chemická štruktúra
- 2 Vlastnosti
- 3 Použitie
- 3.1 Ako katalyzátor
- 4 Účinky na zdravie
- 5 Referencie
Chemická štruktúra
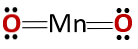
Chemická štruktúra zlúčeniny zodpovedá chemickej štruktúre anhydridu a nie bázickému oxidu, ako by sa dalo očakávať, pretože sa skladá z kovu a nekovového materiálu..
Tento špeciálny prípad je spôsobený chovaním mangánu v rôznych oxidačných stavoch, ktoré má. Pre oxidačné stavy teda tvoria oxidy MnO a Mn oxidy +2 a +32O3 že pri reakcii s vodou tvoria hydroxid manganatý a hydroxid manganičitý.
Avšak Mn2O3 v mierne kyslom prostredí sa správa ako anhydrid. S oxidačnými stavmi +4, +6 a +7, MnO2, MnO3 a MnO4 pri reakcii s vodou tvoria kyseliny.
V mierne kyslom médiu MnO2 chová sa ako bázický oxid, takže môže tvoriť zodpovedajúci hydroxid.

Treba mať na pamäti, že v tomto prípade nie je zmienka o amfoterných vlastnostiach, podľa ktorých sa zlúčenina môže správať ako kyselina alebo ako báza. Toto je špeciálny prípad správania Mn.
vlastnosti
aplikácie
- Používa sa ako zdroj mangánu
- Ako oxidačné činidlo v alkalických batériách
- Farby na sklo, keramiku a porcelán.
- Pri získavaní chlóru a jódu.
- Pri rozklade peroxidu vodíka na tvorbu plynného kyslíka a vody.
- Pri rozkladnej reakcii chlorečnanu draselného na výrobu plynného kyslíka a chloridu draselného.
- Rozpustí sa v acetóne alebo v dichlórmetáne, oxiduje primárne alkoholy na aldehydy a sekundárne na ketóny.
- Výroba alkalických batérií.
Ako katalyzátor
To platí pre oxidačno-redukčné reakcie na odstránenie sulfidov, ako je H2S a katióny ako Fe+2 a Mn+2 , arzén a rádio nájdené v podzemnej vode, ktoré sú kontaminované týmto typom zlúčenín.
Táto kontaminácia môže byť spôsobená nekontrolovaným ukladaním toxických látok, premývaním kontaminovanej pôdy alebo prítomnosťou chemických prvkov v čase extrakcie vody..
MnO2 Vysoká čistota získaná z pyroluzitu použitého ako filter (Filox) je najúčinnejším prostriedkom na odstránenie tejto triedy nečistôt z podzemných vôd.
Účinky na zdravie
- Zabráňte kontaktu s pokožkou.
- V prípade kontaktu umyte zodpovedajúcu oblasť.
- Nevdychujte prášky.
- Pri kontakte s očami je možné pozorovať podráždenie a začervenanie. Umyte veľkým množstvom vody, nechajte vodu prejsť očami a v prípade vážneho ochorenia vyhľadajte lekársku pomoc.
- Pri kontakte s pokožkou sa pozoruje podráždenie a začervenanie. Umyte postihnuté miesto veľkým množstvom vody a mydlom.
- Dlhší kontakt s pokožkou odstraňuje váš prirodzený tuk a spúšťa dermatitídu.
- Vdýchnutie môže spôsobiť stav podobný chrípke (kovové výpary). Tento stav sa vyznačuje vysokou horúčkou, zimnicou, sucho v ústach a hrdle, bolesťou svalov a bolesťou hlavy.
- Môže dráždiť dýchacie cesty a zvýšiť výskyt respiračných infekcií (pneumónia). Intoxikácia absorpciou anorganických solí mangánu cez pľúca je nepravdepodobná, ale môže sa vyskytnúť chronická otrava.
- Chronické vystavenie prachu alebo dymu z oxidu manganičitého počas dlhého obdobia môže ovplyvniť centrálny nervový systém a viesť k rozvoju Parkinsonovej choroby, ťažkostí s chôdzou, svalových spazmov a zmien správania..
- Požitie môže spôsobiť bolesť brucha a nevoľnosť.
- Nie je horľavý, ale pomáha šíriť oheň v žiarovkách. Pri zahrievaní na teplotu nad 535 ° C sa látka rozkladá na oxid manganičitý (III) Mn2O3 a kyslík, ktorý je horľavý a zvyšuje nebezpečenstvo požiaru. V tomto prípade by sa mal oheň uhasiť penou alebo oxidom uhličitým.
- V prípade rozliatia nemanipulujte so zlúčeninou bez náležitej osobnej ochrany.
- Látku skladujte v tesne uzavretých nádobách, na chladnom a suchom mieste a mimo dosahu nekompatibilných látok, ako sú organické materiály a horľavé materiály..
- Skladovacie miesto musí byť suché a musí mať podlahy odolné voči kyselinovej korózii as dobrým odvodnením..
- Mali by sa používať osobné ochranné prostriedky, ako sú rukavice, ochranné okuliare, masky proti parám, prach a dym.
referencie
- B, (2015), oxid manganičitý, Kráľovská spoločnosť chémie - svet chémie, získaný z chemistryworld.com
- Karal, (2014), Mangneso Dioxide, Karta bezpečnostných údajov, Získané z, karal.com.mx
- Váš virtuálny učiteľ (2/25/2015). Anorganické zlúčeniny mangánu (špeciálny prípad 1) - Teoretická lekcia, získaná z youtube.com
- Zafarbený, (s.f), oxid manganičitý, získaný z ecured.cu
- Angarita G, Johnny., (2017), oxid manganičitý: výnimočná technológia. Hidroteco, získané z hydrotecocr.com
- Fernández, G., (2015), MnO Mangan Dioxide2acetón, Organická chémia, Obnovené z quimicaorganica.net
- Tronox, (2011), oxid manganičitý, karta bezpečnostných údajov, získaná z, tronox.com


