Vlastnosti etyléteru, štruktúra, získanie, použitie
etyléter, tiež známy ako dietyléter, je organická zlúčenina, ktorej chemický vzorec je C4H10O. Vyznačuje sa tým, že ide o bezfarebnú a prchavú kvapalinu, a preto sa jej fľaše musia udržiavať čo najtesnejšie uzavreté..
Tento éter sa klasifikuje ako člen dialkyléterov; to znamená, že majú vzorec ROR ', kde R a R' predstavujú rôzne uhlíkové segmenty. A ako opisuje svoje stredné meno, dietyléter, sú dva radikály-etyl, ktoré sa viažu na atóm kyslíka.

Spočiatku bol etyléter použitý ako všeobecné anestetikum, zavedený v roku 1846 Williamom Thomasom Greenom Mortonom. Avšak vzhľadom na jeho horľavosť, jeho použitie bolo zamietnuté a nahradilo ho inými menej nebezpečnými anestetikami..
Táto zlúčenina sa tiež použila na odhad času krvného obehu, počas hodnotenia kardiovaskulárneho stavu pacientov.
V tele môže byť dietyléter premenený na oxid uhličitý a metabolity; posledne menované sa vylučujú močom. Väčšina podaného éteru je však vydychovaná v pľúcach bez akejkoľvek modifikácie.
Na druhej strane sa používa ako rozpúšťadlo pre mydlá, oleje, parfumy, alkaloidy a gumy.
index
- 1 Štruktúra etyléteru
- 1.1 Medzimolekulové sily
- 2 Fyzikálne a chemické vlastnosti
- 2.1 Ostatné názvy
- 2.2 Molekulový vzorec
- 2.3 Molekulová hmotnosť
- 2.4 Fyzický vzhľad
- 2.5 Vôňa
- 2.6 Chuť
- 2.7 Bod varu
- 2.8 Teplota topenia
- 2.9 Bod vzplanutia
- 2.10 Rozpustnosť vo vode
- 2.11 Rozpustnosť v iných kvapalinách
- 2.12 Hustota
- 2.13 Hustota pár
- 2.14 Tlak pár
- 2.15 Stabilita
- 2.16 Automatické zapaľovanie
- 2.17 Rozklad
- 2.18 Viskozita
- 2.19 Teplo spaľovania
- 2.20 Odparovacie teplo
- 2.21 Povrchové napätie
- 2.22 Ionizačný potenciál
- 2.23 Prahová hodnota zápachu
- 2.24 Index lomu
- 3 Získanie
- 3.1 Z etylalkoholu
- 3.2 Z etylénu
- 4 Toxicita
- 5 Použitie
- 5.1 Organické rozpúšťadlo
- 5.2 Celková anestézia
- 5.3 Duch éteru
- 5.4 Hodnotenie krvného obehu
- 5.5 Vyučovacie laboratóriá
- 6 Referencie
Štruktúra etyléteru
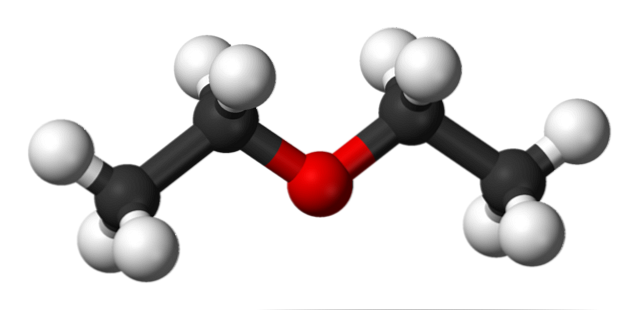
Na obrázku vyššie máme reprezentáciu s modelom guľôčok a tyčí molekulovej štruktúry etyléteru.
Ako je možné vidieť, červená guľa, zodpovedajúca atómu kyslíka, má dve etylové skupiny viazané na oboch stranách. Všetky spoje sú jednoduché, flexibilné a voľne otočné okolo osí σ.
Tieto rotácie vytvárajú stereoizoméry známe ako konforméry; že viac ako izoméry sú alternatívnymi priestorovými stavmi. Štruktúra obrazu presne zodpovedá anti-konforméru, v ktorom sú všetky jeho skupiny atómov rozložené (oddelené od seba).
Aký by bol druhý konformér? Zatienené, a hoci váš obraz nie je k dispozícii, len si ho predstavte s tvarom U. Na horných koncoch U by sa nachádzali metylové skupiny, -CH3, ktoré by zažili sterické odpudzovanie (kolidovali by vo vesmíre).
Preto sa očakáva, že molekula CH3CH2OCH2CH3 prijať proti konformácii väčšinu času.
Medzimolekulové sily
Aké medzimolekulové sily sú molekuly etyléteru riadené v kvapalnej fáze? Sú udržiavané v kvapaline hlavne vďaka disperzným silám, pretože ich dipólový moment (1,5D) nemá oblasť dostatočne deficientnú v elektronickej hustote (δ +)
Je to preto, že žiadny atóm uhlíka etylových skupín neposkytuje príliš veľa elektrónovej hustoty atómu kyslíka. Vyššie uvedené je zrejmé z mapy elektrostatického potenciálu etyléteru po ruke (spodný obrázok). Všimnite si absenciu modrej oblasti.
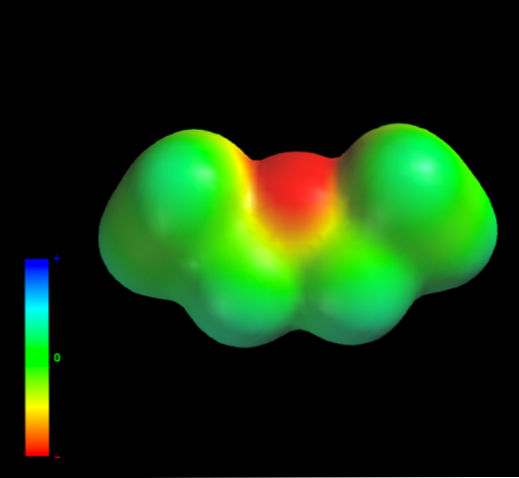
Kyslík nemôže opäť tvoriť vodíkové väzby, pretože v molekulovej štruktúre nie sú k dispozícii žiadne O-H väzby. Preto sú to okamžité dipóly a ich molekulová hmotnosť, ktoré podporujú ich disperzné sily.
Napriek tomu je vysoko rozpustný vo vode. Prečo? Pretože jeho atóm kyslíka, s vyššou hustotou elektrónov, môže akceptovať vodíkové väzby z molekuly vody:
(CH3CH2)2Oδ- - δ+H-OH
Tieto interakcie sú zodpovedné za 6,04 g tohto éteru, ktorý sa rozpustí v 100 ml vody.
Fyzikálne a chemické vlastnosti
Iné mená
-Dietyléter
-ethoxyethanu
-Etyloxid
Molekulový vzorec
C4H100 alebo C2H5)2O.
Molekulová hmotnosť
74,14 g / mol.
Fyzický vzhľad
Bezfarebná kvapalina.
vône
Sladká a korenistá.
príchuť
Horiace a sladké.
Teplota varu
94,3 ° F (34,6 ° C) až 760 mmHg.
Teplota topenia
-177,3 ° F (-116,3 ° C). Stabilné kryštály.
Bod zapálenia
-49 ° F (uzavretý kontajner).
Rozpustnosť vo vode
6,04 g / 100 ml pri 25 ° C.
Rozpustnosť v iných kvapalinách
Miešateľný s alifatickými alkoholmi s krátkym reťazcom, benzénom, chloroformom, petroléterom, rozpúšťadlom tuku, mnohými olejmi a koncentrovanou kyselinou chlorovodíkovou.
Rozpustný v acetóne a veľmi rozpustný v etanole. Je tiež rozpustný v nafte, benzéne a olejoch.
hustota
0,714 mg / ml pri 68 ° F (20 ° C).
Hustota pár
2,55 (vo vzťahu k vzduchu s hustotou 1).
Tlak pary
442 mmHg pri 68 ° F. 538 mmHg pri 25 ° C. 58,6 kPa pri 20 ° C.
stabilita
Pomaly sa oxiduje pôsobením vzduchu, vlhkosti a svetla s tvorbou peroxidov.
Tvorba peroxidov sa môže vyskytovať v éterových nádobách, ktoré boli otvorené a ktoré zostávajú v skladovaní dlhšie ako šesť mesiacov. Peroxidy môžu vybuchnúť trením, nárazom alebo zahriatím.
Zabráňte kontaktu s: zinok, halogény, nekovové oxyhalogenidy, silné oxidačné činidlá, chromylchlorid, tementínové oleje, nitráty a chloridy kovov.
Automatické zapaľovanie
180 ° C (180 ° C).
rozklad
Pri zahrievaní sa rozkladá, vyžaruje prenikavý a dráždivý dym.
viskozita
0,2448 cPoise pri 20 ° C.
Teplo spaľovania
8,807 Kcal / g.
Odparovacie teplo
89,8 cal / g pri 30 ° C.
Povrchové napätie
17,06 dyn / cm pri 20 ° C.
Ionizačný potenciál
9,53 eV.
Prahová hodnota zápachu
0,83 ppm (čistota nie je uvedená).
Index lomu
1,355 pri 15 ° C.
získanie
Z etylalkoholu
Etyléter sa môže získať z etylalkoholu v prítomnosti kyseliny sírovej ako katalyzátora. Kyselina sírová vo vodnom prostredí disociuje produkciu hydróniového iónu, H3O+.
Bezvodý etylalkohol prúdi cez roztok kyseliny sírovej, zahrieva sa medzi 130 ° C a 140 ° C, čím vzniká protonizácia molekúl etylalkoholu. Následne iná molekula neprotonovaného etylalkoholu reaguje s protónovou molekulou.
Keď k tomu dôjde, nukleofilný atak druhej molekuly etylalkoholu podporuje uvoľňovanie vody z prvej molekuly (protonizovanej); ako výsledok sa vytvorí protónovaný etyléter (CH3CH2OHCH2CH3), s čiastočne nabitým pozitívnym kyslíkom.
Tento spôsob syntézy však stráca účinnosť, pretože kyselina sírová sa zriedi vodou vyrobenou v procese (produkt dehydratácie etylalkoholu)..
Teplota reakcie je kritická. Pri teplotách pod 130 ° C je reakcia pomalá a etylalkohol sa destiluje.
Nad 150 ° C, kyselina sírová spôsobuje tvorbu etylénu (alkénu s dvojitou väzbou) namiesto toho, aby sa zmiešal s etylalkoholom za vzniku etyléteru..
Z etylénu
V opačnom postupe, to znamená hydratácii etylénu v plynnej fáze, môže byť ako etylalkohol vytvorený etyléter ako vedľajší produkt. V skutočnosti táto syntetická cesta produkuje väčšinu tejto organickej zlúčeniny.
Tento spôsob využíva katalyzátory na báze kyseliny fosforečnej, ktoré sú fixované na pevnom nosiči, pričom sú schopné prispôsobiť sa produkcii väčšieho množstva éteru.
Dehydratácia etanolu v plynnej fáze v prítomnosti katalyzátorov na báze oxidu hlinitého môže poskytnúť 95% výťažok pri výrobe etyléteru..
toxicity
Kontakt môže spôsobiť podráždenie pokožky a očí. Kontakt s pokožkou môže spôsobiť jeho vysušenie a popraskanie. Éter zvyčajne neprenikne pokožkou, pretože sa rýchlo odparí.
Podráždenie očí spôsobené éterom je zvyčajne mierne a v prípade silného podráždenia je poškodenie zvyčajne reverzibilné..
Jeho požitie spôsobuje narkotické účinky a podráždenie žalúdka. Ťažké požitie môže spôsobiť poškodenie obličiek.
Vdýchnutie éteru môže spôsobiť podráždenie nosa a hrdla. V prípade vdýchnutia éteru sa môže vyskytnúť: ospalosť, vzrušenie, závraty, vracanie, nepravidelné dýchanie a zvýšené slinenie.
Vysoká expozícia môže spôsobiť stratu vedomia a dokonca smrť.
OSHA stanovuje limit pracovnej expozície v priemere 800 ppm v priebehu 8-hodinovej zmeny.
Úrovne podráždenia očí: 100 ppm (človek). Úrovne podráždenia očí: 1200 mg / m3 (400 ppm).
aplikácie
Organické rozpúšťadlo
Je to organické rozpúšťadlo, ktoré sa používa na rozpúšťanie brómu, jódu a iných halogénov; väčšina lipidov (tukov), živíc, čistých kaučukov, niektorých alkaloidov, gumy, parfumov, acetátu celulózy, nitrátu celulózy, uhľovodíkov a farbív.
Okrem toho sa používa pri extrakcii účinných látok živočíšnych tkanív a rastlín, pretože má nižšiu hustotu ako voda a pláva na nej, pričom požadované látky sa rozpúšťajú v éteri..
Celková anestézia
Používa sa ako všeobecné anestetikum od roku 1840 a nahradzuje chloroform za terapeutickú výhodu. Je to však horľavá látka, a preto sa stretáva s ťažkými ťažkosťami pri jej používaní v rámci klinických prostredí.
Okrem toho produkuje u pacientov niektoré nežiaduce postoperačné vedľajšie účinky, ako je nevoľnosť a vracanie.
Z týchto dôvodov sa použitie éteru ako všeobecného anestetika vyradilo a nahradilo ho inými anestetikami, ako je halotán..
Duch éteru
Éter zmiešaný s etanolom sa použil na vytvorenie roztoku nazývaného lieh éteru, ktorý sa používa pri liečení flatulencie žalúdka a miernejších foriem gastralgie.
Hodnotenie krvného obehu
Éter sa používa na hodnotenie krvného obehu medzi ramenom a pľúcami. Éter sa vstrekne do ramena, čím sa krv dostane do pravej predsiene, potom do pravej komory a odtiaľ do pľúc..
Čas, ktorý uplynie od vstreknutia éteru do príjmu éterového zápachu vo vydychovanom vzduchu, je približne 4 až 6 s.
Vyučovacie laboratóriá
Éter sa používa v učebných laboratóriách v mnohých experimentoch; napríklad v demonštrácii Mendelových zákonov genetiky.
Éter sa používa na znecitlivenie múch rodu Drosophila a umožňuje potrebné kríženia medzi nimi, aby sa doložili zákony genetiky.
referencie
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organická chémia. Amíny. (10th vydania.). Wiley Plus.
- Carey F. (2008). Organická chémia (Šieste vydanie). Mc Graw Hill.
- Sevier. (2018). Dietyléter. Science Direct. Zdroj: sciencedirect.com
- Redakcia Encyclopaedia Britannica. (2018). Etyléter. Britannica ncyclopædia. Zdroj: britannica.com
- PubChem (2018). Éter. Zdroj: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2018). Dietyléter. Zdroj: en.wikipedia.org
- Bezpečnostný list XI: etyléter. [PDF]. Získané z: quimica.unam.mx


