Teória modelov pásov a príkladov
teória pásma je ten, ktorý definuje elektronickú štruktúru pevnej látky ako celku. Môže byť aplikovaný na akýkoľvek typ pevnej látky, ale je to v kovoch, kde sa odrážajú jeho najväčšie úspechy. Podľa tejto teórie, kovové väzby vyplývajú z elektrostatickej príťažlivosti medzi pozitívne nabitými iónmi a mobilnými elektrónmi v kryštáli..
Preto má kovový kryštál "more elektrónov", ktoré môže vysvetliť jeho fyzikálne vlastnosti. Spodný obrázok znázorňuje kovový spoj. Fialové bodky elektrónov sú delokalizované v mori, ktoré obklopuje pozitívne nabité atómy kovu.

"More elektrónov" sa tvorí z jednotlivých príspevkov každého atómu kovu. Tieto príspevky sú jeho atómové orbitály. Kovové štruktúry sú všeobecne kompaktné; čím sú kompaktnejšie, tým väčšie sú interakcie medzi ich atómami.
Výsledkom je, že ich atómové orbitály sa prekrývajú a vytvárajú veľmi úzke molekulárne orbity v energii. More elektrónov je potom len veľkou množinou molekulárnych orbitálov s rôznymi rozsahmi energií. Rozsah týchto energií tvorí to, čo je známe ako energetické pásy.
Tieto kapely sú prítomné v akejkoľvek oblasti kryštálu, čo je dôvod, prečo je považovaný za celok a odtiaľ prichádza definícia tejto teórie.
index
- 1 Model energetických pásiem
- 1.1 Úroveň Fermi
- 2 Polovodiče
- 2.1 Vnútorné a vonkajšie polovodiče
- 3 Príklady aplikovanej teórie pásiem
- 4 Odkazy
Model energetických pásiem

Keď s orbitál atómu kovu interaguje s jeho susedom (N = 2), tvoria sa dva molekulárne orbitály: jeden z väzieb (zelený pás) a jeden z anti-link (tmavo červený pás).
Ak N = 3, teraz sa tvoria tri molekulárne orbitály, z ktorých stredný (čierny pás) je neväzbový. Ak N = 4, vytvoria sa štyri orbitály a jeden s najväčším väzbovým charakterom a ten s najväčším protizámrazovým charakterom sa ďalej oddelia.
Rozsah energie dostupnej pre molekulárne orbitály sa rozširuje, pretože atómy kovu kryštálu poskytujú svoje orbitály. To tiež vedie k zníženiu energetického priestoru medzi orbitálmi do tej miery, že kondenzujú v pásme.
Táto kapela zložená z orbitálov má oblasti s nízkou energiou (zelené a žlté farby) a vysokú energiu (oranžové a červené farby). Ich energetické extrémy majú nízku hustotu; väčšina molekulárnych orbitálov (biely pruh) sa však koncentruje v strede.
To znamená, že elektróny „bežia rýchlejšie“ cez stred pásma ako na ich koncoch.
Úroveň Fermi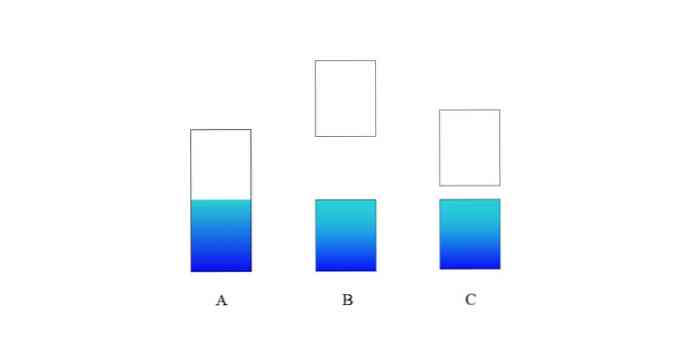
Je to najvyšší energetický stav obsadený elektrónmi v pevnej látke pri absolútnej nulovej teplote (T = 0 K).
Akonáhle je kapela postavená, elektróny začnú obsadzovať všetky svoje molekulárne orbitály. Ak má kov jeden valenčný (é) elektrón (y)1), všetky elektróny v jeho kryštáli zaberajú polovicu pásma.
Druhá neobsadená polovica je známa ako hnacia skupina, zatiaľ čo skupina plná elektrónov sa nazýva valenčná skupina.
Na hornom obrázku A predstavuje typický valenčný pás (modrý) a vodivý pás (biely) pre kov. Namodralá hranica označuje úroveň Fermi.
Pretože kovy majú tiež p-orbitály, kombinujú sa rovnakým spôsobom, aby vznikli p-pásmo (biele).
V prípade kovov sú pásy s a p veľmi blízke energii. To umožňuje ich prekrývanie, čo podporuje elektróny z valenčného pásma do vodivého pásma. To sa deje aj pri teplotách mierne nad 0 K.
Pre prechodové kovy a od obdobia 4 smerom nadol je tiež možné vytvoriť pásy z.
Na určenie elektrických vlastností je veľmi dôležitá hladina Fermi vzhľadom na vodivostný pás.
Napríklad kov Z s úrovňou Fermi, ktorý je veľmi blízko pásma vodivosti (najbližší prázdny pás v energii) má vyššiu elektrickú vodivosť než kov X, v ktorom je jeho úroveň Fermi ďaleko od tohto pásma..
Semiconductors
Elektrická vodivosť potom pozostáva z migrácie elektrónov z valenčného pásma do vodivého pásma.
Ak je energetická medzera medzi oboma pásmi veľmi veľká, máme izolačnú pevnú látku (ako u B). Na druhej strane, ak je táto medzera relatívne malá, tuhá látka je polovodič (v prípade C).
V dôsledku zvýšenia teploty získavajú elektróny vo valenčnom pásme dostatok energie na migráciu smerom k vodivému pásmu. Výsledkom je elektrický prúd.
V skutočnosti ide o kvalitu tuhých látok alebo polovodičových materiálov: pri izbovej teplote sú izolátory, ale pri vysokých teplotách sú vodiče..
Vnútorné a vonkajšie polovodiče

Vnútorné vodiče sú tie, v ktorých energetická medzera medzi valenčným pásom a vodivým pásom je dostatočne malá, aby tepelná energia umožňovala prechod elektrónov..
Na druhej strane vonkajšie vodiče vykazujú zmeny vo svojich elektronických štruktúrach po dotovaní nečistotami, ktoré zvyšujú ich elektrickú vodivosť. Táto nečistota môže byť iný kov alebo nekovový prvok.
Ak má nečistota viac valenčných elektrónov, môže poskytnúť donorový pás, ktorý slúži ako mostík pre elektróny valenčného pásma na prechod do vodivého pásma. Tieto pevné látky sú polovodiče typu n. Tu n označenie pochádza z "negatívnych".
V hornom obrázku je pruh darcu zobrazený v modrom bloku tesne pod riadiacou páskou (Typ n).
Na druhej strane, ak má nečistota menej valenčných elektrónov, poskytuje akceptorové pásmo, ktoré skracuje energetickú medzeru medzi valenčným pásmom a riadiacim pásmom..
Elektrony najprv migrujú smerom k tomuto pásmu, zanechávajúc za sebou "pozitívne otvory", ktoré sa pohybujú v opačnom smere.
Pretože tieto pozitívne medzery označujú priechod elektrónov, tuhá látka alebo materiál je polovodič typu p..
Príklady aplikovanej teórie pásiem
- Vysvetlite, prečo sú kovy jasné: ich mobilné elektróny môžu absorbovať žiarenie v širokom spektre vlnových dĺžok, keď skočia na vyššie energetické hladiny. Potom vydávajú svetlo a vracajú sa na nižšiu úroveň pásma.
- Najdôležitejším polovodičovým materiálom je kryštalický kremík. Ak je časť kremíka dopovaná stopami prvku skupiny 13 (B, Al, Ga, In, Tl), stáva sa polovodičom typu p. Zatiaľ čo ak je dopovaný prvkom skupiny 15 (N, P, As, Sb, Bi), stáva sa polovodičom typu n.
- Svetelná dióda (LED) je kĺbový polovodič p-n. Čo tým myslíš? Že materiál má oba typy polovodičov, ako n, tak p. Elektrony migrujú z vodivého pásma polovodiča n-typu do valenčného pásma polovodiča typu p.
referencie
- Whitten, Davis, Peck & Stanley. Chémia. (8. vydanie). CENGAGE Learning, str. 486-490.
- Shiver & Atkins. (2008). Anorganická chémia (Štvrté vydanie, str. 103-107, 633-635). Mc Graw Hill.
- Loď C. R. (2016). Pásová teória pevných látok. Získané dňa 28. apríla 2018, z: hyperphysics.phy-astr.gsu.edu
- Steve Kornic (2011). Chystáte sa z dlhopisov do kapiel z pohľadu lekárne. Získané dňa 28. apríla 2018, z: chembio.uoguelph.ca
- Wikipedia. (2018). Vonkajší polovodič. Získané dňa 28. apríla 2018, z: en.wikipedia.org
- Byju'S. (2018). Pásová teória kovov. Získané dňa 28. apríla 2018, z: byjus.com



