Štruktúra, vlastnosti, názvoslovie, použitie, sulfid strieborný (Ag2S)
sulfid strieborný "Anorganická zlúčenina" je anorganická zlúčenina, ktorej chemický vzorec je Ag2Skladá sa z čiernošedej pevnej látky tvorenej Ag katiónmi+ a anióny S2- v pomere 2: 1. S2- je veľmi podobný Ag+, pretože obe sú mäkké ióny a dokážu sa navzájom stabilizovať.
Strieborné ozdoby majú tendenciu stmavnúť, strácajú svoj charakteristický lesk. Zmena farby nie je produktom oxidácie striebra, ale jeho reakcie s sírovodíkom prítomným v prostredí pri nízkych koncentráciách; To môže pochádzať zo zhnitia alebo degradácie rastlín, zvierat alebo potravín bohatých na síru.

H2S, ktorého molekula nesie atóm síry, reaguje so striebrom podľa nasledujúcej chemickej rovnice: 2Ag (s) + H2S (g) => Ag2S (s) + H2(G)
Preto Ag2S je zodpovedný za čierne vrstvy vytvorené na striebre. V prírode sa však táto síra nachádza aj v mineráloch acantita a argentita. Tieto dva minerály sa odlišujú od mnohých iných svojimi čiernymi a jasnými kryštálmi, podobne ako tuhá látka v hornom obrázku.
Ag2S predstavuje polymorfné štruktúry, atraktívne elektronické a optoelektronické vlastnosti, je polovodičový a sľubuje, že bude materiálom pre vývoj fotovoltaických zariadení, ako sú solárne články..
index
- 1 Štruktúra
- 2 Vlastnosti
- 2.1 Molekulová hmotnosť
- 2.2 Vzhľad
- 2.3 Vôňa
- 2.4 Teplota topenia
- 2.5 Rozpustnosť
- 2.6 Štruktúra
- 2.7 Index lomu
- 2.8 Dielektrická konštanta
- 2.9 Elektronika
- 2.10 Redukčná reakcia
- 3 Nomenklatúra
- 3.1 Systematika
- 3.2
- 3.3 Tradičné
- 4 Použitie
- 5 Referencie
štruktúra
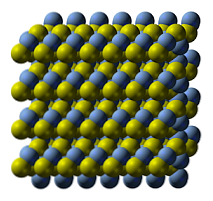
Kryštalická štruktúra sulfidu striebra je znázornená na hornom obrázku. Modré guľôčky zodpovedajú katiónom Ag+, zatiaľ čo žlté na anióny S2-. Ag2S je polymorfný, čo znamená, že za určitých teplotných podmienok môže prijať niekoľko kryštalických systémov.
Ako? Prostredníctvom fázového prechodu. Ióny sú preskupené takým spôsobom, že zvýšenie teploty a vibrácie pevnej látky nenarušujú rovnováhu elektrostatického príťažlivosti. Keď k tomu dôjde, hovorí sa, že dochádza k fázovému prechodu a tuhá látka preto vykazuje nové fyzikálne vlastnosti (ako je lesk a farba)..
Ag2S pri normálnych teplotách (nižších ako 179 ºC) má monoklinickú kryštalickú štruktúru (α-Ag2S). Okrem tejto pevnej fázy existujú ešte dve ďalšie: bcc (kubický centrovaný v tele) medzi 179 až 586 ° C a fcc (kubický stred v tvárach) pri veľmi vysokých teplotách (δ- Ag2S).
Minerál argentitu pozostáva z fcc fázy, známej tiež ako β-Ag2S. Po ochladení a transformácii na útes prevládajú ich štrukturálne znaky. Preto obe kryštalické štruktúry koexistujú: monoklinické a bcc. Preto sa objavia čierne pevné látky s jasnými a zaujímavými podtónmi.
vlastnosti
Molekulová hmotnosť
247,80 g / mol
vzhľad
Sivasté čierne kryštály
vône
toaletný.
Teplota topenia
836ºC. Táto hodnota súhlasí so skutočnosťou, že Ag2S je zlúčenina s malým iónovým charakterom, a preto sa topí pri teplotách pod 1000 ° C.
rozpustnosť
Vo vode len 6,21 ∙ 10-15 g / l pri 25 ° C. To znamená, že množstvo čiernej pevnej látky, ktorá je solubilizovaná, je zanedbateľné. Toto je opäť spôsobené malým polárnym charakterom väzby Ag-S, kde nie je významný rozdiel elektronegativity medzi oboma atómami..
Tiež Ag2S je nerozpustný vo všetkých rozpúšťadlách. Žiadna molekula nemôže účinne oddeliť svoje kryštalické vrstvy v iónoch Ag+ a S2- rozpustená.
štruktúra
Štyri vrstvy S-Ag-S väzieb je možné vidieť aj na obraze štruktúry, ktorá sa navzájom pohybuje, keď je tuhá látka podrobená porozumeniu. Toto správanie znamená, že napriek tomu, že je polovodič, je pri izbovej teplote ťažký ako mnoho kovov.
Vrstvy S-Ag-S sú vhodné pre ich uhlové geometrie, ktoré sú pozorované ako cik-cak. S silou porozumenia sa pohybujú na osi posunu, čo spôsobuje nové nekovalentné interakcie medzi atómami striebra a síry..
Index lomu
2.2
Dielektrická konštanta
6
elektronický
Ag2S je amfoterný polovodič, to znamená, že sa chová, ako keby bol typu n a typu p. Tiež nie je krehká, preto bola skúmaná pre jej použitie v elektronických zariadeniach.
Redukčná reakcia
Ag2S sa môže redukovať na kovové striebro kúpaním čiernych kúskov teplou vodou, NaOH, hliníkom a soľou. Prebieha nasledujúca reakcia:
3AG2S (s) + 2Al (s) + 3H20 (l) => 6Ag (s) + 3H2S (ac) + Al2O3(S)
názvoslovie
Striebro, ktorého elektronická konfigurácia je [Kr] 4d105S1, môže stratiť len jeden elektrón: najvzdialenejší orbitál 5s. Teda Ag katión+ zostáva s elektronickou konfiguráciou [Kr] 4d10. Preto má jedinečnú mocnosť +1, ktorá určuje, ako sa majú jej zlúčeniny nazývať.
Síra má na druhej strane elektronickú konfiguráciu [3]23p4, a potrebuje dva elektróny na dokončenie svojho valenčného oktetu. Keď získava tieto dva elektróny (zo striebra), premieňa sa na anión síry, S2-, s konfiguráciou [Ar]. To znamená, že je izoelektronický k ušľachtilému plynu argónu.
Takže Ag2S sa musí nazývať podľa nasledujúcich názvov:
systematika
opicesulfid disilver. Uvažujeme o počte atómov každého prvku a sú označené predponami gréckych čitateľov.
sklad
Sulfid strieborný. Keď má jedinečnú valenciu +1, nie je špecifikovaná rímskymi číslicami v zátvorkách: sulfid strieborný (I); ktorý je nesprávny.
tradičné
Sulphuro argéntico. Vzhľadom k tomu, strieborné "pracuje" s valenciou +1, prípona -ico je pridaný k jeho názvu Argentum v latinčine.
aplikácie
Niektoré z nových spôsobov použitia Ag2S sú nasledujúce:
-Roztoky roztokov ich nanočastíc (s rôznymi veľkosťami), majú antibakteriálnu aktivitu, nie sú toxické, a preto ich možno použiť v oblasti medicíny a biológie..
-Ich nanočastice môžu tvoriť tzv. Kvantové bodky. Tieto absorbujú a vyžarujú žiarenie s väčšou intenzitou ako mnohé organické fluorescenčné molekuly, takže ich môžu nahradiť ako biologické markery.
-Štruktúry a-Ag2S vytvárajú výrazné elektronické vlastnosti, ktoré sa používajú ako solárne články. Predstavuje tiež východiskový bod pre syntézu nových termoelektrických materiálov a senzorov.
referencie
- Mark Peplow. (17. apríl 2018). Polovodičový sulfid sa rozprestiera ako kov. Prevzaté z: cen.acs.org
- Spolupráca: Autori a redaktori zväzku III / 17E-17F-41C () kryštálovej štruktúry sulfidu striebra (Ag2S). In: Madelung O., Rössler U., Schulz M. (eds) Non-Tetrahedrally Bonded Elements a binárne zlúčeniny I. Landolt-Börnstein - skupina III kondenzovaných látok (numerické údaje a funkčné vzťahy vo vede a technike), zv. 41C. Springer, Berlín, Heidelberg.
- Wikipedia. (2018). Sulfid strieborný. Prevzaté z: en.wikipedia.org
- Stanislav I. Sadovnikov a kol. (Júl 2016). ag2S nanočastice sulfidu striebra a koloidné roztoky: Syntéza a vlastnosti. Prevzaté z: sciencedirect.com
- Azo materiály. (2018). Sulfid strieborný (Ag2S) Polovodiče. Prevzaté z: azom.com
- A. Nwofe. (2015). Vyhliadky a výzvy tenkých vrstiev sulfidu strieborného: prehľad. Divízia materiálovej vedy a obnoviteľnej energie, Katedra priemyselnej fyziky, Ebonyi State University, Abakaliki, Nigéria.
- UMassAmherst. (2011). Prednáška Demonštrácie: čistenie strieborného náteru. Prevzaté z: lecturedemos.chem.umass.edu
- Štúdia. (2018). Čo je to sulfid striebra? - Chemický vzorec a použitia. Prevzaté z: study.com


