Sulfid sodný, vzorce, použitia, riziká
sulfid sodný (Na2S) je kryštalická pevná látka od žltej po tehlovo červenú. V prírode sa nachádza v rôznych stupňoch hydratácie, pričom najbežnejším je nonahydrát síranu sodného (Na2S · 9H2O).
Sú to vo vode rozpustné soli, ktoré poskytujú silne alkalické roztoky. Keď sú vystavené vlhkému vzduchu, absorbujú vlhkosť zo vzduchu, ktorý sa môže samovoľne zahriať a spôsobiť vznietenie okolitých horľavých materiálov. Podobne v kontakte s vlhkým vzduchom emitujú sírovodík, ktorý voní ako zhnité vajcia.

Sú to silné redukčné činidlá. Tieto látky môžu byť nebezpečné pre životné prostredie, najmä pre vodné organizmy.
Monosulfid sodný je komerčne dostupný vo forme vločiek obsahujúcich 60 až 62% Na2S ...
- vzorca

- CAS: 1313-82-2 Sulfid sodný (bezvodý)
- CAS: 1313-84-4 Sulfid sodný (nonahydrovaný)
2D štruktúra
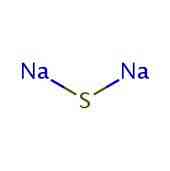
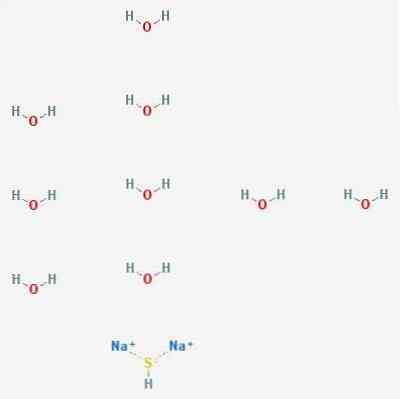
3D štruktúra
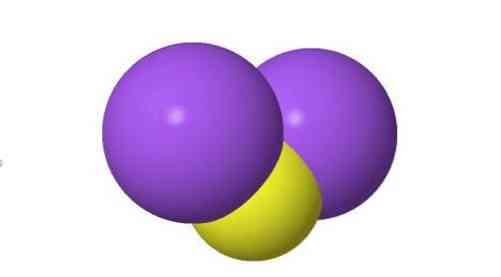
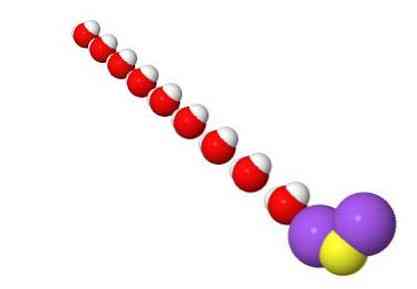
Charakteristika sulfidu sodného
Fyzikálne a chemické vlastnosti

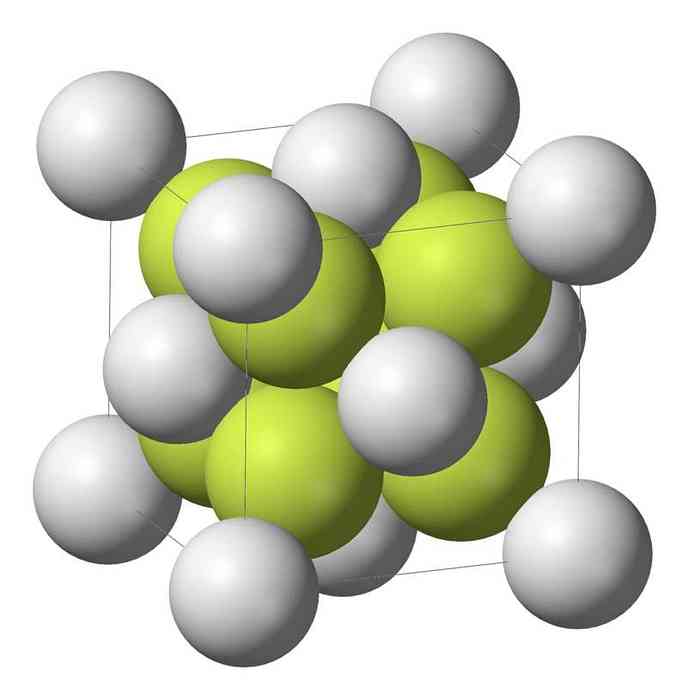
monosulfide sodný (Na2S) kryštalizuje s antifluorite štruktúrou, v ktorej je každý atóm S obklopený nábojom 8 atómov Na a každý atóm Na o štvorstena štyroch atómov S.
zápalnosť
Jediným vysoko horľavým členom skupiny anorganických sulfidov je sírovodík. Niektoré iné anorganické sulfidy, ako je napríklad sulfid sodný, sa však môžu samovoľne zahriať a dokonca sa môžu vznietiť, ak sú vystavené vlhkosti..
Pri vystavení ohňu sulfid sodný uvoľňuje plyny alebo výpary oxidu siričitého, ktoré sú dráždivé alebo toxické.
reaktivita
- Anorganické sulfidy sú vo všeobecnosti zásadité (niektoré sú silne zásadité, a preto sú nekompatibilné s kyselinami).
- Mnohé z týchto zlúčenín sú redukčné činidlá (reagujú prudko s oxidačnými činidlami).
- Sulfidy jednoduché soli (ako je napríklad sulfid sodný, draselný a amónny) prudko reagovať s kyselinami za uvoľnenie sírovodíka plyn, vysoko toxické a horľavé.
- Sulfid sodný je horľavý. Pri prudkom zahriatí alebo zasiahnutí môže vybuchnúť.
- Keď sa zahrieva na rozklad, vyžaruje toxické výpary oxidu sodného a oxidov síry.
- Prudko reaguje s uhlíkom, s aktívnym uhlím, diazóniovými soľami, N, N-dichlórmetylamínom, silnými oxidačnými činidlami a vodou..
toxicity
Mnohí členovia skupiny anorganických sulfidov sa správajú ako silné zásady a môžu spôsobiť ťažké popáleniny pri kontakte s pokožkou.
Táto vlastnosť závisí od jej rozpustnosti. Najviac nerozpustné anorganické sulfidy (napríklad sulfid ortuti a sulfid kademnatý) nie sú žieravé.
Sulfid sodný má rozdeľovací koeficient oktanol / voda (Pow) (-3,5). Táto hodnota sa používa ako miera rozpustnosti (a biokoncentrácie) látky v živočíšnych tukových tkanivách (najmä vodných živočíchoch)..
Sulfid sodný sa považuje za nebezpečný pre životné prostredie, najmä pre vodné organizmy.
aplikácie
Doma, sulfid sodný sa používa v odtokovej otvárač, pre domácnosť (pre mikrovlnné rúry, kúpeľni), vyrovnávanie vlasov, umývanie riadu mydlom a automobilových airbagov.
V priemysle sa používa v čistiacich prostriedkoch, v cemente a ako prekurzor pri výrobe iných chemických výrobkov.
Klinické účinky
Expozícia sulfidu sodnému je bežná v rozvinutých krajinách av zaostalých krajinách, a to v priemysle aj doma. Tieto korozívne látky sú prítomné v niekoľkých výrobkoch pre domácnosť v nízkej koncentrácii.
V rozvinutých krajinách sú závažné účinky zriedkavé. Tieto sa vyskytujú hlavne v dôsledku úmyselného požitia chemikálie u dospelých. V rozvojových krajinách sú však závažné účinky častejšie.
Alkalické žieraviny spôsobujú nekrózu v dôsledku skvapalňovania. Zmydelňujú tuky v bunkovej membráne, ničia bunku a umožňujú hlboký prienik do tkaniva slizníc.
Perorálna expozícia
Počiatočný zápal sa vyskytuje v gastrointestinálnom tkanive, po ktorom nasleduje nekróza tkaniva (s možnou perforáciou), potom granulácia a nakoniec tvorba stenózy.
U pacientov s miernym požitím sa vyvinú popáleniny podráždenia alebo stupňa I (povrchová hyperémia a edém) orofaryngu, pažeráka alebo žalúdka..
U pacientov so stredne ťažkou intoxikáciou sa môžu vyvinúť popáleniny stupňa II (povrchové pľuzgiere, erózie a ulcerácie) s možnou ďalšou tvorbou stenózy (najmä pažeráka).
U niektorých pacientov (najmä u malých detí) sa môže vyvinúť edém v horných dýchacích cestách.
Pacienti s ťažkou orálna toxicita môže rozvíjať hlboké popáleniny a nekrózu sliznicu zažívacieho traktu, s komplikáciami, ako je perforácia (pažeráka, žalúdka, dvanástnika vzácny čas), fistuly (tracheoezofageálnou, aortoesophageal) a krvácanie do zažívacieho traktu.
sa môže vyvinúť hypotenzia, tachykardia, tachypnoe, tvorby striktúr (predovšetkým pažeráka), karcinóm pažeráka a edém horných dýchacích ciest (čo je bežné a často život ohrozujúce).
Ťažká otrava je vo všeobecnosti obmedzená na úmyselný príjem u dospelých.
Expozícia vdychovaním
Mierna expozícia môže spôsobiť kašeľ a bronchospazmus.
Silné vdychovanie môže spôsobiť edém horných dýchacích ciest, popáleniny, stridor a zriedkavo akútne poškodenie pľúc..
Očná expozícia
Môže vyvolať vážne podráždenie spojiviek a chemózu, defekty epitelu rohovky, ischémiu končatiny, trvalú stratu zraku a závažné prípady perforácie..
Dermálna expozícia
Mierna expozícia spôsobuje podráždenie a čiastočné popáleniny. U pacientov s ťažkými popáleninami alebo šokom sa môže vyvinúť metabolická acidóza.
Dlhodobá expozícia alebo produkty s vysokou koncentráciou môžu spôsobiť celkové popáleniny.
Bezpečnosť a riziká
Výstražné upozornenia globálne harmonizovaného systému klasifikácie a označovania chemikálií (SGA) \ t
Globálne harmonizovaný systém klasifikácie a označovania chemikálií (SGA) je medzinárodne dohodnutý systém, ktorý vytvorila Organizácia Spojených národov a ktorý má nahradiť rôzne normy klasifikácie a označovania používané v rôznych krajinách s použitím konzistentných kritérií na celom svete..
triedy nebezpečnosti (a jeho zodpovedajúce kapitola GHS) klasifikácie a označovanie normy a odporúčania pre sulfidu sodného (Európska chemická agentúra, 2017, OSN, 2015; PubChem, 2017):







referencie
- Benjah-bmm27, (2006). Fluorit-unit-cell-3D-ionic [image] Zdroj: wikipedia.org.
- ChemIDplus, (2017). 1313-82-2 [image] Zdroj: chem.nlm.nih.gov.
- ChemIDplus, (2017). 3D štruktúra 1313-82-2 - Sulfid sodný [image] Zdroj: chem.nlm.nih.gov.
- ChemIDplus, (2017). 3D štruktúra 1313-84-4 - Sulfid sodný [image] Zdroj: chem.nlm.nih.gov.
- Európskej chemickej agentúry (ECHA). (2017). Zhrnutie klasifikácie a označovania.
- Harmonizovaná klasifikácia - príloha VI k nariadeniu (ES) č. 1272/2008 (nariadenie CLP). Sulfid sodný. Získané 16. januára 2017 na adrese: echa.europa.eu.
- Európskej chemickej agentúry (ECHA). (2017). Zhrnutie klasifikácie a označovania.
- Oznámená klasifikácia a označovanie. Sulfid sodný, hydratovaný. Získané 16. januára 2017 na adrese: echa.europa.eu.
- Banka pre údaje o nebezpečných látkach (HSDB). TOXNET. (2017). Sulfid sodný. Bethesda, MD, EU: Národná lekárska knižnica. Zdroj: toxnet.nlm.nih.gov.
- Lange, L., & Triebel, W. (2000). Sulfidy, polysulfidy a sulfány. V Ullmannovej encyklopédii priemyselnej chémie. Wiley-VCH Verlag GmbH & Co. KGaA. Zdroj: dx.doi.org.
- Organizácia spojených národov (2015). Globálne harmonizovaný systém klasifikácie a označovania chemických výrobkov (SGA) Šieste revidované vydanie. New York, Spojené štáty americké: Publikácia Organizácie Spojených národov. Zdroj: unece.org.
- Národné centrum pre informácie o biotechnológiách. PubChem Compound Database. (2016). Enneahydrát sulfidu sodného - PubChem Štruktúra [image] Zdroj: pubchem.ncbi.nlm.nih.gov.
- Národné centrum pre informácie o biotechnológiách. PubChem Compound Database. (2017). Monosulfid sodný. Bethesda, MD, EU: Národná lekárska knižnica. Zdroj: pubchem.ncbi.nlm.nih.gov.
- Národné centrum pre informácie o biotechnológiách. PubChem Compound Database. (2017). Enrihydrát sulfidu sodného. Bethesda, MD, EU: Národná lekárska knižnica. Zdroj: pubchem.ncbi.nlm.nih.gov.
- Národná správa oceánov a atmosféry (NOAA). CAMEO Chemikálie. (2017). Chemický informačný list. Sulfid sodný, bezvodý. Silver Spring, MD. EÚ; Zdroj: cameochemicals.noaa.gov.
- Národná správa oceánov a atmosféry (NOAA). CAMEO Chemikálie. (2017). Dátový list Reactive Group. Sulfidy, Anorganické. Silver Spring, MD. EÚ; Zdroj: cameochemicals.noaa.gov.
- Ondřej Mangl, (2007). Sulfid sodný - Na2S [image] Zdroj: wikipedia.org.
- PubChem, (2016). Monosulfid sodný [obrázok] Zdroj: puchem.nlm.nih.gov.
- PubChem, (2016). Enneahydrát sulfidu sodného [image] Zdroj: puchem.nlm.nih.gov.
- Wikipedia. (2017). Rozdeľovací koeficient oktanol-voda. Získané 17. januára 2017, z: wikipedia.org.
- Wikipedia. (2017). Sulfid sodný. Získané 17. januára 2017, z: wikipedia.org.


