Vzorec pre osmolaritu, ako ho vypočítať a rozdiel s osmolalitou
osmolarita je parameter, ktorý meria koncentráciu chemickej zlúčeniny v litri roztoku, pokiaľ prispieva ku koligačnej vlastnosti známej ako osmotický tlak uvedeného roztoku..
V tomto zmysle osmotický tlak roztoku sa týka množstva tlaku potrebného na spomalenie procesu osmózy, ktorý je definovaný ako selektívny prechod častíc rozpúšťadla pomocou polopriepustnej alebo poréznej membrány z roztoku. nižšej koncentrácie na koncentrovanejšie.
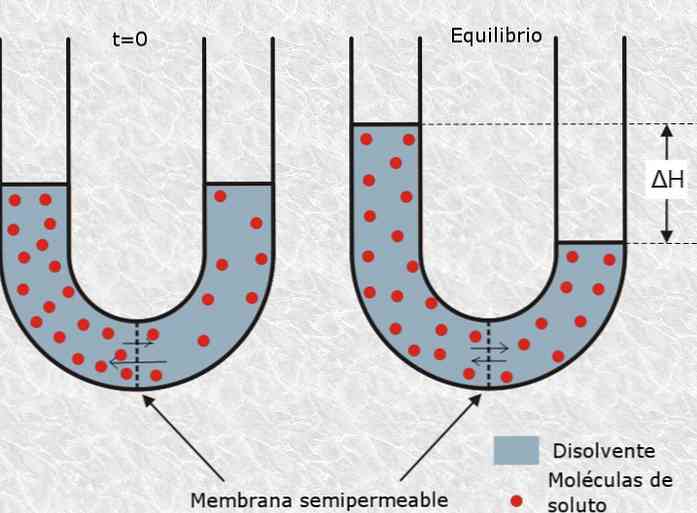
Tiež Jednotka vyjadrujúca množstvo rozpustených častíc osmole (Osem symbolom), ktorý nie je súčasťou Medzinárodnej sústavy jednotiek (SI), ktorý sa používa v takmer každý. Takže koncentrácia rozpustenej látky v roztoku je definovaná v jednotkách na liter osmolů (Osem / l).
index
- 1 Vzorec
- 1.1 Definícia premenných vo vzorci osmolarity
- 2 Ako ho vypočítať?
- 3 Rozdiely medzi osmolaritou a osmolalitou
- 4 Odkazy
vzorec
Ako už bolo uvedené, osmolarita (tiež známa ako osmotická koncentrácia) je vyjadrená v jednotkách definovaných ako Osm / l. Je to spôsobené vzťahom s určením osmotického tlaku a meraním difúzie rozpúšťadla pomocou osmózy.
V praxi môže byť osmotická koncentrácia určená ako fyzikálna veličina s použitím osmometra.
Osmometer je prístroj používaný pri meraní osmotického tlaku roztoku, ako aj stanovenie ďalších koligačných vlastností (ako je tlak pary, zvýšenie teploty varu alebo depresia bodu tuhnutia) na získanie hodnoty osmolarity roztoku.
Týmto spôsobom sa na výpočet tohto parametra merania použije nasledujúci vzorec, ktorý berie do úvahy všetky faktory, ktoré môžu ovplyvniť túto vlastnosť..
Osmolarita = ΣφjanjaCja
V tejto rovnici je osmolarita stanovená ako súčet vyplývajúci z násobenia všetkých hodnôt získaných z troch rôznych parametrov, ktoré budú definované nižšie..
Definícia premenných vo vzorci osmolarity
V prvom rade je to osmotický koeficient, reprezentovaný gréckym písmenom φ (phi), ktorý vysvetľuje, ako ďaleko sa riešenie ideálneho správania odsťahuje, alebo inými slovami, stupeň neideálnosti, ktorý sa solute prejavuje v riešení..
Najjednoduchším spôsobom φ sa označuje stupeň disociácie rozpustenej látky, ktorý môže mať hodnotu medzi nulou a jednou, pričom maximálna hodnota jednotky predstavuje disociáciu 100%; to je absolútne.
V niektorých prípadoch, ako napríklad sacharóza, táto hodnota prevyšuje jednotu; zatiaľ čo v iných prípadoch, ako napríklad v prípade solí, vplyv elektrostatických interakcií alebo síl spôsobuje osmotický koeficient s hodnotou nižšou ako je jednota, aj keď nastane absolútna disociácia.
Na druhej strane hodnota n označuje množstvo častíc, v ktorých sa molekula môže disociovať. V prípade iónových druhov je ako príklad uvedený chlorid sodný (NaCl), ktorého hodnota n je rovná dvom; zatiaľ čo v neionizovanej molekule glukózy je hodnota n rovná jednej.
Nakoniec hodnota c predstavuje koncentráciu rozpustenej látky vyjadrenú v molárnych jednotkách; a dolný index i označuje identitu špecifickej rozpustenej látky, ale musí byť rovnaký, ak sa vynásobia tri uvedené faktory a získa sa osmolarita..
Ako ho vypočítať?
V prípade iónovej zlúčeniny KBr (známej ako bromid draselný), ak máte vo vode roztok s koncentráciou rovnou 1 mol / l KBr, predpokladá sa, že má osmolaritu rovnú 2 osmol / l..
Je to spôsobené jeho silným elektrolytickým charakterom, ktorý podporuje jeho úplnú disociáciu vo vode a umožňuje uvoľňovanie dvoch nezávislých iónov (K+ a Br-), ktoré majú nejaký elektrický náboj, takže každý mol KBr sa rovná dvom osmolom v roztoku.
Analogicky pre roztok s koncentráciou rovnou 1 mol / l BaCl2 (známy ako chlorid bárnatý) vo vode, má osmolaritu rovnú 3 osmol / l.
Je to preto, že sa uvoľňujú tri nezávislé ióny: Ba ión2+ a dva ióny Cl-. Potom každý mol BaCl2 zodpovedá trom osmolom v roztoku.
Na druhej strane neionogénne druhy nepodliehajú takejto disociácii a vytvárajú jeden osmol pre každý mol rozpustenej látky. V prípade roztoku glukózy s koncentráciou rovnajúcou sa 1 mol / l sa to rovná 1 osmol / l roztoku.
Rozdiely medzi osmolaritou a osmolalitou
Osmol je definovaná ako počet častíc, ktoré sú rozpustené v rovnakom objeme 22,4 litra rozpúšťadla, podrobia na teplotu 0 ° C a spôsobuje generovanie osmotického tlaku rovnom 1 atm. Všimnite si, že tieto častice sú považované osmoticky aktívne.
V tomto zmysle sa vlastnosti známe ako osmolarita a osmolalita vzťahujú na rovnaké meranie: koncentrácia rozpustenej látky v roztoku alebo, inak povedané, obsah celkových častíc rozpustenej látky v roztoku..
Základný rozdiel, ktorý je stanovený medzi osmolaritou a osmolalitou, je v jednotkách, v ktorých je každý reprezentovaný:
Osmolarita sa vyjadruje v množstve látky na objem roztoku (tj osmol / l), zatiaľ čo osmolalita sa vyjadruje v množstve látky na hmotnosť rozpúšťadla (tj osmol / kg roztoku)..
V praxi sa oba parametre používajú ľahostajným spôsobom, dokonca sa prejavujú v rôznych jednotkách, vzhľadom na to, že medzi celkovými veličinami rôznych meraní je nedoceniteľný rozdiel..
referencie
- Wikipedia. (N. D.). Osmotická koncentrácia. Zdroj: es.wikipedia.org
- Chang, R. (2007). Chémia, deviate vydanie. Mexiko: McGraw-Hill.
- Evans, D. H. (2008). Osmotická a iónová regulácia: Bunky a zvieratá. Zdroj: books.google.co.ve
- Potts, W. T., a Parry, W. (2016). Osmotická a iónová regulácia u zvierat. Zdroj: books.google.co.ve
- Armitage, K. (2012). Vyšetrenia vo všeobecnej biológii. Zdroj: books.google.co.ve


