Raoultov zákon Čo sa skladá z pozitívnych a negatívnych odchýlok
Raoultov zákon bol navrhnutý francúzskou chemikou François-Marie Raoult v roku 1887 a slúži na vysvetlenie správania tlaku pár roztoku dvoch miešateľných látok (zvyčajne ideálnych) v závislosti od parciálneho tlaku pár každej zložky prítomnej v tomto materiáli..
Existujú zákony chémie, ktoré sa používajú na opis správania sa látok v rôznych podmienkach a vysvetľujú javy, v ktorých sú zahrnuté, s použitím vedecky overených matematických modelov. Jedným z nich je Raoultov zákon.

Pomocou vysvetlenia založeného na interakciách medzi molekulami plynov (alebo kvapalín) s cieľom predpovedať správanie tlakov výparov sa tento zákon používa na štúdium neideálnych alebo reálnych riešení za predpokladu, že potrebné koeficienty sa považujú za potrebné na opravu modelu. matematické a prispôsobiť ho ideálnym podmienkam.
index
- 1 Z čoho sa skladá??
- 2 Pozitívne a negatívne odchýlky
- 2.1 Pozitívne odchýlky
- 2.2 Negatívne odchýlky
- 3 Príklady
- 3.1 Základná zmes
- 3.2 Binárna zmes s neprchavým rozpúšťadlom
- 4 Odkazy
Z čoho sa skladá??
Raoultov zákon je založený na predpoklade, že riešenia sa správajú ideálnym spôsobom: toto sa deje preto, lebo tento zákon je založený na myšlienke, že intermolekulové sily medzi rôznymi molekulami sú rovnaké ako medzi podobnými molekulami (ktoré v skutočnosti to nie je také úspešné).
V skutočnosti, čím bližšie je riešenie ideálnosti, tým viac možností bude musieť spĺňať charakteristiky navrhované týmto zákonom..
Tento zákon sa týka tlaku pár roztoku s neprchavým rozpúšťadlom, pričom sa uvádza, že sa bude rovnať tlaku pary tejto čistej látky pri tejto teplote, vynásobenej jej molárnym zlomkom. Toto je vyjadrené v matematických pojmoch pre jeden komponent nasledujúcim spôsobom:
Pja = Pºja . Xja
V tomto výraze Pja sa rovná parciálnemu tlaku pár zložky i v zmesi plynov Pºja je tlak pary čistej zložky i a Xja je molárny zlomok zložky i v zmesi.
Rovnakým spôsobom, keď máte niekoľko zložiek v riešení a dosiahli stav rovnováhy, môžete vypočítať celkový tlak pary roztoku kombináciou Raoultovho zákona s Daltonovým:
P = PºX + PºBXB + PºCXC...
Tiež v tých roztokoch, kde je prítomná len jedna rozpustená látka a rozpúšťadlo, môže byť zákon formulovaný tak, ako je uvedené nižšie:
P = (1-XB) x Pº
Pozitívne a negatívne odchýlky
Riešenia, ktoré možno študovať s týmto zákonom, by sa mali normálne správať ideálne, pretože interakcie medzi ich molekulami sú malé a umožňujú, aby sa v celom riešení predpokladali rovnaké vlastnosti bez výnimky..
Ideálne riešenia však v skutočnosti prakticky neexistujú, preto musia byť do výpočtov, ktoré predstavujú intermolekulové interakcie, zahrnuté dva koeficienty. Sú to koeficient fugacity a koeficient aktivity.
V tomto zmysle sú odchýlky vzhľadom na Raoultov zákon definované ako kladné alebo záporné, v závislosti od výsledkov získaných v tom čase.
Pozitívne odchýlky
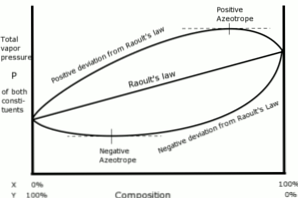
Pozitívne odchýlky, pokiaľ ide o Raoultov zákon, nastanú vtedy, keď je tlak pary roztoku väčší ako to, čo bolo vypočítané podľa Raoultovho zákona.
To sa stáva, keď súdržnosť síl medzi podobnými molekulami je väčšia ako rovnaké sily medzi rôznymi molekulami. V tomto prípade sa obidve zložky odparia ľahšie.
Táto odchýlka je pozorovaná v krivke tlaku pary ako maximálneho bodu v konkrétnej kompozícii, čím sa vytvára pozitívny azeotrop.
Azeotrop je kvapalná zmes dvoch alebo viacerých chemických zlúčenín, ktorá sa chová tak, ako keby bola tvorená jednou zložkou a ktorá sa odparuje bez zmeny zloženia..
Negatívne odchýlky
Negatívne odchýlky od Raoultovho zákona nastanú vtedy, keď tlak pary zmesi je nižší ako sa očakávalo po výpočte podľa zákona.
Tieto odchýlky sa objavia, keď súdržné sily medzi molekulami zmesi sú väčšie ako priemer síl medzi časticami kvapalín v ich čistom stave.
Tento typ odchýlky vytvára retenciu každej zložky v jej kvapalnom stave príťažlivými silami, ktoré sú väčšie ako sily látky v jej čistom stave, takže sa zníži parciálny tlak pár systému..
Negatívne azeotropy v krivkách tlaku pary predstavujú minimálny bod a preukazujú afinitu medzi dvomi alebo viacerými zložkami, ktoré sú súčasťou zmesi..
Príklady
Raoultov zákon sa bežne používa na výpočet tlaku roztoku na základe jeho intermolekulových síl, pričom sa vypočítajú vypočítané hodnoty s reálnymi hodnotami, aby sa dospelo k záveru, či existuje nejaká odchýlka a či by mala byť kladná alebo záporná. Nižšie sú uvedené dva príklady použitia Raoultovho zákona:
Základná zmes
Nasledujúca zmes, pozostávajúca z propánu a butánu, predstavuje aproximáciu tlaku pary a môžeme predpokladať, že obe zložky sú v ňom v rovnakom pomere (50-50) pri teplote 40 ° C:
Xpropán = 0,5
Pºpropán = 1352,1 kPa
Xbután = 0,5
Pºbután = 377,6 kPa
Vypočítava sa podľa Raoultovho zákona:
Pzmes = (0,5 x 377,6 kPa) + (0,5 x 1352,1 kPa)
takže:
Pzmes = 864,8 kPa
Binárna zmes s neprchavým rozpúšťadlom
Niekedy sa stáva, že rozpustená zmes je neprchavá, takže zákon sa používa na pochopenie správania tlaku pary.
Vzhľadom na zmes vody a cukru v pomere 95% a 5% a za normálnych teplotných podmienok:
Xvoda = 0,95
Pºvoda = 2,34 kPa
Xcukor = 0,05
Pºcukor = 0 kPa
Vypočítava sa podľa Raoultovho zákona:
Pzmes = (0,95 x 2,34 kPa) + (0,05 x 0 kPa)
takže:
Pzmes = 2,22 kPa
Zjavne došlo k poklesu tlaku vodnej pary v dôsledku účinkov medzimolekulových síl.
referencie
- Anne Marie Helmenstine, P. (s.f.). Definícia Raoultovho zákona. Zdroj: thinkco.com
- ChemGuide. (N. D.). Raoultov zákon a netěkavé látky. Zdroj: chemguide.co.uk
- LibreTexts. (N. D.). Raoultov zákon a ideálne zmesi kvapalín. Zdroj: chem.libretexts.org
- Neutrium. (N. D.). Raoultov zákon. Zdroj: neutrium.net
- Wikipedia. (N. D.). Raoultov zákon. Zdroj: en.wikipedia.org


