Štruktúra, vlastnosti, syntéza a použitie cyklohexénu
cyklohexen "Alkén" je alkénový alebo cyklický olefín, ktorého molekulový vzorec je C6H10. Skladá sa z bezfarebnej kvapaliny, nerozpustnej vo vode a miešateľnej s mnohými organickými rozpúšťadlami. Vyznačuje sa horľavosťou a v prírode sa zvyčajne nachádza v uhoľnom dechte..
Cyklohexén sa syntetizuje čiastočnou hydrogenáciou benzénu a dehydratáciou alkoholového cyklohexanolu; to znamená viac hrdzavejšia forma. Podobne ako iné cykloalkény, podlieha reakciám elektrofilnej adície a voľných radikálov; napríklad halogenačnú reakciu.
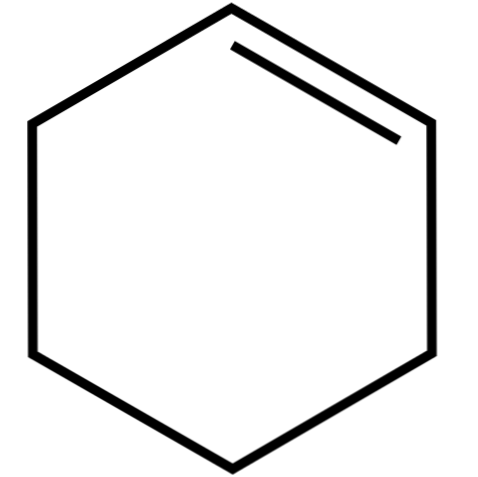
Tento cyklický alkén (vrchný obrázok) tvorí azeotropické zmesi (nedeliteľné destiláciou) s nižšími alkoholmi a kyselinou octovou. Nie je veľmi stabilný pri dlhodobom skladovaní, pretože sa rozkladá pôsobením slnečného žiarenia a ultrafialového žiarenia.
Cyklohexén sa používa ako rozpúšťadlo, a preto má mnoho aplikácií, ako napríklad: stabilizátor vysokooktánových benzínov a na extrakciu olejov..
Ale najdôležitejšou vecou je, že cyklohexén slúži ako medziprodukt a surovina na výrobu mnohých užitočných zlúčenín, medzi ktoré patria: cyklohexanón, kyselina adipová, kyselina maleínová, cyklohexán, butadién, kyselina cyklohexylkarboxylová atď..
index
- 1 Štruktúra cyklohexénu
- 1.1 Intermolekulárne interakcie
- 2 Vlastnosti
- 2.1 Chemické názvy
- 2.2 Molekulová hmotnosť
- 2.3 Fyzický vzhľad
- 2.4 Vôňa
- 2.5 Teplota varu
- 2.6 Teplota topenia
- 2.7 Bod vzplanutia
- 2.8 Rozpustnosť vo vode
- 2.9 Rozpustnosť v organických rozpúšťadlách
- 2.10 Hustota
- 2.11 Hustota pár
- 2.12 Tlak pár
- 2.13 Automatické zapaľovanie
- 2.14 Rozklad
- 2.15 Viskozita
- 2.16 Teplo spaľovania
- 2.17 Teplo na odparovanie
- 2.18 Povrchové napätie
- 2.19 Polymerizácia
- 2.20 Prahová hodnota zápachu
- 2.21 Index lomu
- 2,22 pH
- 2.23 Stabilita
- 2.24 Reakcie
- 3 Zhrnutie
- 4 Použitie
- 5 Riziká
- 6 Referencie
Štruktúra cyklohexénu
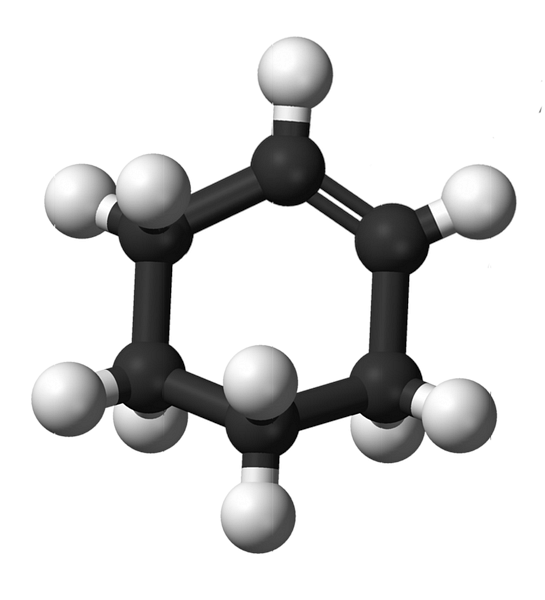
Štruktúra cyklohexénu s modelom guličiek a tyčiniek je znázornená na obrázku vyššie. Je možné pozorovať šesť uhlíkový kruh a dvojitú väzbu, obe nenasýtenia zlúčeniny. Z tohto hľadiska sa zdá, že kruh je plochý; ale vôbec nie.
U štartérov majú uhlíky dvojitej väzby sp hybridizáciu2, ktorá im dáva trigonálnu geometriu roviny. Tieto dva uhlíky a tie, ktoré sú k nim priliehajúce, sú preto v rovnakej rovine; zatiaľ čo dva atómy uhlíka na opačnom konci (k dvojitej väzbe) sú nad a pod uvedenou rovinou.
Nižší obrázok dokonale ilustruje, čo bolo práve vysvetlené.

Všimnite si, že čierny pásik sa skladá zo štyroch uhlíkov: dvoch dvojitých väzieb a ďalších susedných. Exponovaná perspektíva je taká, ktorá by sa získala, keby divák umiestnil svoje oko priamo pred dvojitú väzbu. Je vidieť, že uhlík je nad a pod touto rovinou.
Pretože molekula cyklohexénu nie je statická, obidva uhlíky sa budú vymieňať: jedna bude nižšia, zatiaľ čo druhá bude stúpať nad rovinu. Takže by ste očakávali, že sa táto molekula bude správať.
Intermolekulárne interakcie
Cyklohexén je uhľovodík, a preto jeho intermolekulové interakcie sú založené na disperzných silách Londýna.
Je to preto, lebo molekula je nepolárna, bez permanentného dipólového momentu a jej molekulová hmotnosť je faktorom, ktorý najviac prispieva k udržaniu kohézie v kvapaline..
Dvojitá väzba tiež zvyšuje stupeň interakcie, pretože sa nemôže pohybovať s rovnakou flexibilitou ako ostatné uhlíky, čo podporuje interakciu medzi susednými molekulami. Z tohto dôvodu má cyklohexén mierne vyššiu teplotu varu (83 ° C) ako cyklohexán (81 ° C)..
vlastnosti
Chemické názvy
Cyklohexén, tetrahydrobenzén.
Molekulová hmotnosť
82,146 g / mol.
Fyzický vzhľad
Bezfarebná kvapalina.
vône
Sladká vôňa.
Teplota varu
83 ° C až 760 mmHg.
Teplota topenia
-103,5 ° C.
Bod zapálenia
-7 ° C (uzavretý pohár).
Rozpustnosť vo vode
Prakticky nerozpustný (213 mg / l).
Rozpustnosť v organických rozpúšťadlách
Miešateľný s etanolom, benzénom, tetrachlórmetánom, petroléterom a acetónom. Očakáva sa, že bude schopný rozpustiť nepolárne zlúčeniny, ako niektoré z alotropov uhlia.
hustota
0,810 g / cm3 pri 20 ° C.
Hustota pár
2,8 (vzhľadom na vzduch, ktorý sa berie ako rovný 1).
Tlak pary
89 mmHg pri 25 ° C.
samovznietenia
244 ° C.
rozklad
Rozkladá sa v prítomnosti solí uránu pôsobením slnečného žiarenia a ultrafialového žiarenia.
viskozita
0,625 mPascal pri 25 ° C.
Teplo spaľovania
3,751,7 kJ / mol pri 25 ° C.
Odparovacie teplo
30,46 kJ / mol pri 25 ° C.
Povrchové napätie
26,26 mN / m.
polymerizácie
Za určitých podmienok môže polymerizovať.
Prahová hodnota zápachu
0,6 mg / m3.
Index lomu
1,4465 pri 20 ° C.
pH
7-8 pri 20 ° C.
stabilita
Cyklohexén nie je počas dlhodobého skladovania veľmi stabilný. Vystavenie svetlu a vzduchu môže spôsobiť tvorbu peroxidov. Rovnako je nekompatibilný so silnými oxidačnými činidlami.
reakcie
-Cykloalkény sa vyskytujú hlavne pri adičných reakciách, ako elektrofilných, tak voľných radikálov.
-Reakcia s brómom za vzniku 1,2-dibrómcyklohexánu.
-Rýchlo oxiduje v prítomnosti manganistanu draselného (KMnO)4).
-Je schopný produkovať epoxid (cyklohexénoxid) v prítomnosti kyseliny peroxybenzoovej.
syntéza
Cyklohexén sa vyrába kyslou katalýzou cyklohexanolu:
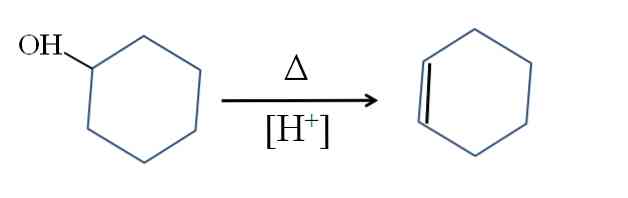
Symbol A predstavuje teplo potrebné na podporu výstupu OH skupiny ako molekuly vody v kyslom médiu (-OH2+).
Cyklohexén sa tiež vyrába parciálnou hydrogenáciou benzénu; to znamená, že dve z jeho dvojitých väzieb pridávajú molekulu vodíka:
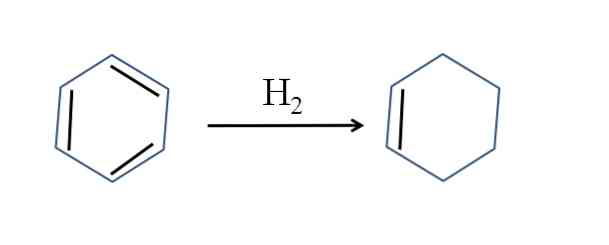
Hoci sa zdá, že reakcia je jednoduchá, vyžaduje veľký tlak H2 a katalyzátory.
aplikácie
-Je použiteľný ako organické rozpúšťadlo. Okrem toho je to surovina na výrobu kyseliny adipovej, adipového aldehydu, kyseliny maleínovej, cyklohexánu a kyseliny cyklohexylkarboxylovej..
-Používa sa pri výrobe cyklohexánchloridu, zlúčeniny používanej ako sprostredkovateľ pri výrobe farmaceutických výrobkov a prísad do gumy..
-Cyklohexén sa tiež používa pri syntéze cyklohexanónu, suroviny na výrobu liekov, pesticídov, parfumov a farbív..
-Cyklohexén sa zúčastňuje syntézy aminocyklohexanolu, zlúčeniny, ktorá sa používa ako povrchovo aktívna látka a emulgátor..
-Okrem toho sa cyklohexén môže použiť na prípravu butadiénu v laboratóriu. Táto zlúčenina sa používa pri výrobe syntetického kaučuku, pri výrobe pneumatík pre automobily a používa sa tiež pri výrobe akrylových plastov..
-Cyklohexén je surovina na syntézu lyzínu, fenolu, polycykloolefínovej živice a gumových aditív.
-Používa sa ako stabilizátor vysokooktánových benzínov.
-Podieľa sa na syntéze vodotesných náterov, fólií odolných proti praskaniu a viažucich spojív na nátery.
riziká
Cyklohexén nie je veľmi toxická zlúčenina, ale môže spôsobiť sčervenanie kože a očí kontaktom. Jeho inhalácia môže spôsobiť kašeľ a ospalosť. Okrem toho môže požitie spôsobiť ospalosť, ťažkosti s dýchaním a nevoľnosť.
Cyklohexén sa slabo absorbuje v gastrointestinálnom trakte, takže sa neočakávajú žiadne závažné systémové účinky v dôsledku požitia. Najväčšou komplikáciou je jej aspirácia dýchacím systémom, ktorá môže spôsobiť chemickú pneumóniu.
referencie
- Joseph F. Chiang a Simon Harvey Bauer. (1968). Molekulová štruktúra cyklohexénu. J. Am., Chem. 1969, 91, 8, 1898-1901.
- Karry Barnes. (2019). Cyklohexén: Nebezpečenstvo, syntéza a štruktúra. Štúdia. Zdroj: study.com
- Morrison, R. T. a Boyd, R. N. (1987). Organická chémia (5ta Vydanie.). Editorial Addison-Wesley Iberoamericana.
- PubChem. (2019). Cyklohexen. Zdroj: pubchem.ncbi.nlm.nih.gov
- Chemická kniha. (2019). Cyklohexen. Zdroj: chemicalbook.com
- Toxikologická dátová sieť. (2017). Cyklohexen. TOXNET. Zdroj: toxnet.nlm.nih.gov
- Chemoxy. (N. D.). Štruktúrny vzorec pre cyklohexén je. Zdroj: chemoxy.com


