Ziehl-Neelsen Stain Foundation, reagencie a technika
Ziehl-Neelsenovo farbivo v technike farbenia na identifikáciu mikroorganizmov odolných voči alkoholu (AAR). Názov tohto mikrobiologického postupu sa vzťahuje na jeho autorov: bakteriológa Franza Ziehla a patológa Friedricha Neelsena.
Táto technika je typom diferenciálneho zafarbenia, čo znamená použitie rôznych farieb, aby sa vytvoril kontrast medzi štruktúrami, ktoré chcete pozorovať, diferencovať a neskôr identifikovať. Ziehl-Neelsenovo farbivo sa používa na identifikáciu určitých typov mikroorganizmov.
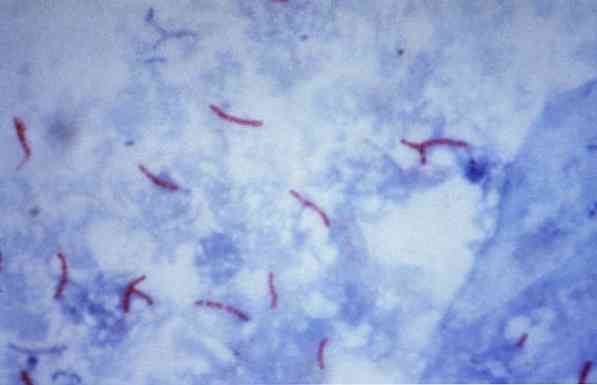
Niektoré z týchto mikroorganizmov sú mykobaktérie (napríklad, Mycobacterium tuberculosis), nocardias (napríklad, Nocardia sp.) a niektoré jednobunkové parazity (napríklad, Cryptosporidium parvum). Mnohé baktérie môžu byť klasifikované pomocou bežnej techniky nazývanej Gramovo farbenie.
Niektoré bakteriálne skupiny však vyžadujú iné metódy na ich identifikáciu. Techniky, ako je Ziehl-Neelsenovo farbenie, vyžadujú kombinácie farbív s teplom, aby sa prvý fixoval na bunkovú stenu.
Potom prichádza proces zafarbenia, ktorý umožňuje dva výsledky: rezistenciu alebo citlivosť na zmenu farby kyselinami a alkoholmi.
index
- 1 Nadácia
- 1.1 Sekundárne farbenie
- 2 Reagenty
- 2.1 Primárne sfarbenie
- 2.2 Odfarbovací roztok
- 2.3 Sekundárne sfarbenie (anti-farbivo)
- 3 Technika
- 3.1 Postup farbenia pomocou kyseliny
- 4 Odkazy
nadácie
Základ tejto techniky farbenia je založený na vlastnostiach týchto mikroorganizmov na bunkovej stene. Stena je tvorená typom mastných kyselín nazývaných mykolové kyseliny; Vyznačujú sa veľmi dlhými reťazami.
Keď majú mastné kyseliny veľmi dlhé štruktúry, môžu ľahšie zadržiavať farbivá. Niektoré rody baktérií sa veľmi ťažko farbia farbením Gramom, čo je spôsobené vysokým obsahom kyseliny mykolovej v bunkovej stene.
V Ziehl-Neelsenovom farbive sa používa fenolická zlúčenina karbol fuchsin, bázické farbivo. To má schopnosť interakcie s mastnými kyselinami bunkovej steny, čo je voskovitá textúra pri teplote miestnosti.
Zafarbenie karbol fuchsínom sa zlepší v prítomnosti tepla, pretože vosk sa topí a molekuly farbív sa pohybujú rýchlejšie do bunkovej steny..
Kyselina, ktorá sa použije neskôr, slúži na odfarbenie buniek, ktoré neboli zafarbené, pretože ich stena nebola dostatočne príbuzná s farbivom; preto je pevnosť kyselinového odfarbovača schopná odstrániť kyslé farbivo. Bunky, ktoré odolávajú tomuto odfarbeniu, sa nazývajú odolné voči kyselinám.
Sekundárne farbenie
Po odfarbení vzorky sa to kontrastuje s iným farbivom nazývaným sekundárne farbivo. Všeobecne sa používa metylénová modrá alebo malachitová zelená.
Sekundárne farbivo farbí podkladový materiál a následne vytvára kontrast so štruktúrami, ktoré boli farbené v prvom kroku. Iba sfarbené bunky absorbujú druhé farbivo (proti škvrnám) a berú svoju farbu, zatiaľ čo bunky odolné voči kyselinám si zachovávajú červenú farbu..
Tento postup sa často používa na identifikáciu Mycobacterium tuberculosis a Mycobacterium leprae, ktoré sa nazývajú acidorezistentné bacily.
činidlá
Primárne sfarbenie
Použije sa karboxín 0,3% fuchsin (filtrovaný). Toto farbivo sa pripraví zo zmesi alkoholov: fenolu v etanole (90%) alebo metanolu (95%) a v tejto zmesi sa rozpustia 3 gramy bázického fuchsínu..
Decolorizing roztok
V tomto kroku môžete použiť roztoky 3% alkoholu alebo 25% kyseliny sírovej.
Sekundárne farbenie (anti-farbivo)
Najčastejšie používaným farbivom na uskutočnenie kontrastu vo vzorkách je zvyčajne 0,3% metylénovej modrej. Môžu sa však použiť aj iné, ako napríklad 0,5% malachitová zelená.
technika
Postup farbenia pomocou kyseliny
Pripravte bakteriálny náter
Tento prípravok sa vyrába na čistom a suchom sklíčku po dodržaní preventívnych opatrení.
Sušenie šmuhy
Nechajte uschnúť pri izbovej teplote.
Vzorku zahrejte
Vzorka musí byť zahrievaná ohňom na podložné sklíčko nižšie. Fixáciu alkoholom je možné vykonať, keď sa náter neupravil so spútom (ošetrený chlórnanom sodným na jeho bielenie) a ak sa nemá farbiť okamžite..
M. tuberculosis Odstraňuje sa bielidlom a počas procesu farbenia. Termofixovanie nespracovaného spúta nebude zabíjať M. tuberculosis, keďže fixácia alkoholom je baktericídna.
Zakryte škvrnu
Škvrna je pokrytá roztokom karbol fuchsínu (primárne základné farbenie)..
Zohrejte škvrnu
Toto sa vykonáva po dobu 5 minút. Mali by ste si všimnúť uvoľňovanie pár (približne 60 ° C). Je dôležité, aby nedošlo k prehriatiu a nevypáleniu vzorky.
Pokiaľ ide o zahrievanie škvŕn, je potrebné venovať veľkú pozornosť pri zahrievaní karbolu fuchsin, najmä ak sa farbenie vykonáva na podnose alebo inej nádobe, v ktorej boli odoberané vysoko horľavé chemikálie..
Pod sklíčka by sa mal aplikovať len malý plameň s použitím svetlého tampónu navlhčeného niekoľkými kvapkami kyslého alkoholu, metanolu alebo 70% etanolu. Vyhnite sa použitiu veľkého tampónu namočeného v etanole, pretože to predstavuje nebezpečenstvo požiaru.
Umyte škvrnu
Toto pranie by sa malo vykonávať čistou vodou. Ak voda z vodovodu nie je čistá, opláchnite ju najlepšie filtrovanou alebo destilovanou vodou.
Obal zakryte kyslým alkoholom
Tento kyslý alkohol by mal byť 3%. Pokrytie sa vykonáva po dobu 5 minút alebo dovtedy, kým nie je rozter dostatočne sfarbený, to znamená bledoružový.
Je potrebné vziať do úvahy, že kyslý alkohol je horľavý; preto sa musí používať veľmi opatrne. Vyhýbajte sa blízkosti zdrojov zapálenia.
Umyte škvrnu
Pranie by malo byť čisté, destilované.
Obal zakryte farbivom
Môže to byť zelené malachitové (0,5%) alebo metylénové modré (0,3%) farbivo po dobu 1 alebo 2 minút, s použitím najdlhšieho času, ak je rozter tenký..
Umyte škvrnu
Znova sa musí použiť čistá voda (destilovaná).
vypustiť
Zadná strana sklíčka by sa mala očistiť a škvrna by sa mala umiestniť na drenážnu poličku tak, aby bola vysušená na vzduchu (na sušenie nepoužívajte absorpčný papier).
Preskúmajte škvrnu v mikroskope
Použije sa 100x objektív a imerzný olej. Systém systematicky skenujte a zapíšte príslušné pozorovania.
Interpretujte výsledky
Teoreticky sa mikroorganizmy, ktoré sa farbia načervenalú farbu, považujú za pozitívne na kyselinu (AAR +)..
Naopak, ak sú mikroorganizmy zafarbené modro alebo zelene, v závislosti od farbiva použitého ako protifarbivo, sú považované za negatívne kyseliny odolné voči alkoholu (AAR-)..
referencie
- Apurba, S. & Sandhya, B. (2016). Základy praktickej mikrobiológie (1. vydanie). Lekárske vydavateľstvá Jaypee Brothers.
- Bauman, R. (2014). Mikrobiológia s chorobami podľa Body System (4. vydanie). Pearson Education, Inc.
- Heritage, J., Evans, E. & Killington, A. (1996). Úvodná mikrobiológia (1. vydanie). Cambridge University Press.
- Morello, J., Granato, P. Wilson, M. & Morton, V. (2006). Laboratórny manuál a zošit v mikrobiológii: Aplikácie pre starostlivosť o pacienta (11. vydanie). Vzdelávanie McGraw-Hill.
- Vasanthakumari, R. (2007). Učebnica mikrobiológie (1. vydanie). B.I. Publikácie PVT.


