Farbiace základy Giemsa, materiály, technika a použitie
Giemsa farbivo je typ farbenia klinických vzoriek, založený na zmesi kyselín a zásaditých farbív. Jeho tvorba bola inšpirovaná prácou Romanowského, kde ho Gustav Giemsa, chemik a bakteriológ pôvodne z Nemecka, zdokonalil pridaním glycerolu na stabilizáciu zlúčenín..
Zmeny vytvorené v pôvodnej technike Romanowského umožnili výrazne zlepšiť mikroskopické pozorovania, preto bola technika pokrstená menom Giemsa škvrny.
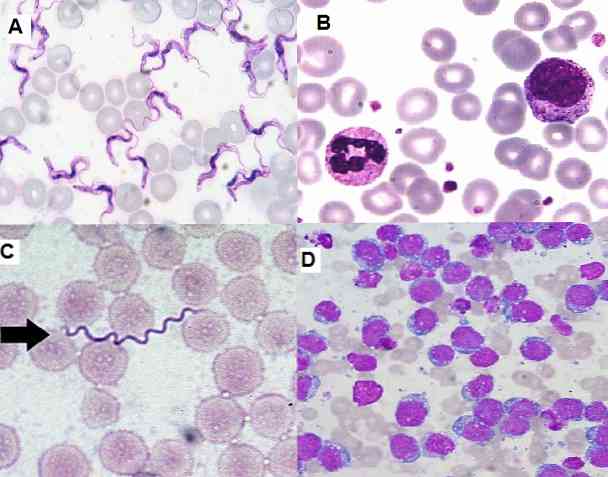
Pretože je to jednoduchá technika, ktorá je vysoko funkčná a ekonomická, je v súčasnosti široko používaná v klinickom laboratóriu na hematologické stery, vzorky kostnej drene a tkanivové rezy..
Technika farbenia Giemsa je veľmi užitočná pre cytologické štúdie, pretože umožňuje pozorovanie špecifických štruktúr buniek. Táto technika zafarbuje cytoplazmy, jadrá, jadrá, vakuoly a granule buniek, pričom dokáže rozlíšiť aj jemné stopy chromatínu.
Okrem toho je možné detegovať významné zmeny veľkosti, tvaru alebo sfarbenia jadra, kde je možné vizualizovať stratu vzťahu nukleus-cytoplazma..
Na druhej strane umožňuje identifikovať nezrelé bunky v kostnej dreni a periférnej krvi, ktoré sú dôležité pre diagnostiku závažných ochorení, ako je leukémia. Je tiež možné detegovať okrem iného hemoparazity, extra a intracelulárne baktérie, huby.
V cytogenetike sa používa celkom, pretože je možné študovať mitózu buniek.
index
- 1 Založenie sfarbenia Giemsa
- 2 Materiály
- 2.1 Materiály na prípravu materského roztoku
- 2.2 Spôsob prípravy materského roztoku
- 2.3 Materiály na prípravu tlmivého roztoku
- 2.4 Konečná príprava farbiva
- 2.5 Dodatočné materiály potrebné na vykonanie farbenia
- 3 Technika
- 3.1 Proces farbenia
- 4 Nástroje
- 4.1 Hematológia
- 4.2 Mykológia
- 4.3 Bakteriológia
- 4.4 Parazitológia
- 4.5 Cytológia
- 4.6 Cytogenetika
- 5 Výskum demonštrujúci účinnosť farbenia Giemsa
- 6 Odporúčania pre dobré farbenie
- 7 Bežné chyby vo vyfarbení Giemsa
- 7.1 Extrémne modré sfarbenie
- 7.2 Príliš ružové sfarbenie
- 7.3 Prítomnosť zrazenín v nátere
- 7.4 Prítomnosť morfologických artefaktov
- 8 Režim skladovania
- 9 Referencie
Založenie sfarbenia Giemsa
Farby typu Romanowsky sú založené na použití kontrastu medzi kyselinami a zásaditými farbivami, aby sa dosiahlo farbenie bázických a kyselinových štruktúr. Ako je možné vidieť, existuje afinita kyslých farbív na farbenie základných štruktúr a naopak.
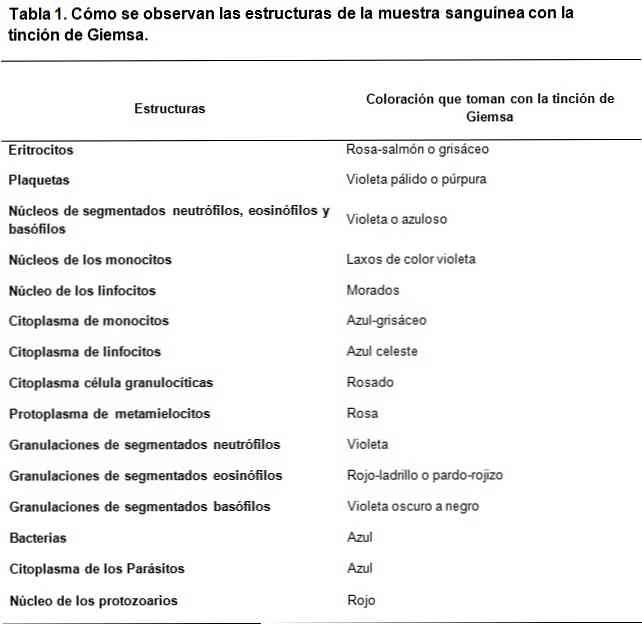
Ako základné farbivo sa používa metylénová modrá a jeho oxidované deriváty (Azure A a Azure B), zatiaľ čo kyslé farbivo je eozín.
Kyslé štruktúry buniek sú okrem iného nukleové kyseliny, granule segmentovaných bazofilov, preto budú farbené metylénovou modrou.
V tomto istom zmysle sú základnými štruktúrami buniek hemoglobín a niektoré granule, ako napríklad tie, ktoré sú obsiahnuté v segmentovaných eozinofiloch, okrem iného; tieto budú farbené eozínom.
Na druhej strane, vzhľadom na to, že metylénová modrá a azúrová sú charakterizované metachromatickými farbivami, môžu poskytovať rôzny tón rôznym štruktúram podľa zaťaženia polyaniónov, ktoré majú..
Takto je strategická kombinácia základných a kyslých farbív schopná vyvinúť široké spektrum farieb podľa biochemických charakteristík každej štruktúry, prechádzajúcich svetlomodrými, tmavomodrými, fialovými a fialovými tónmi v prípade kyslých štruktúr..
Zatiaľ čo sfarbenie poskytnuté eozínom je stabilnejšie, vytvára farby medzi červeno-oranžovou a lososovou.
materiály
Materiály na prípravu materského roztoku
Príprava zásobného roztoku vyžaduje odváženie 600 mg práškového farbiva Giemsa, meranie 500 cm3 metylalkoholu neobsahujúceho acetón a 50 cm3 neutrálneho glycerínu..
Spôsob prípravy materského roztoku
Ťažký prášok Giemsa umiestnite do malty. Ak sú hrče, mali by byť striekané. Následne pridajte značné množstvo zmeraného glycerínu a veľmi dobre premiešajte. Získaná zmes sa naleje do veľmi čistej jantárovej fľaše.
Zvyšok glycerínu sa umiestni do malty. Znovu premiešajte, aby ste vyčistili zvyšné farbivo prilepené na stenách malty a nalejte do tej istej fľaše.
Fľaša sa zakryje a uchováva sa 2 hodiny vo vodnom kúpeli pri teplote 55 ° C. Kým v kúpeli bain-marie, zmes mierne premiešajte každú pol hodinu.
Následne sa zmes nechá vychladnúť, aby sa umiestnil alkohol. Predtým sa časť odmeraného alkoholu umiestni do malty na dokončenie premývania zvyšku farbiva a potom sa pridá do zmesi spolu so zvyškom alkoholu..
Tento prípravok by sa mal nechať dozrieť najmenej 2 týždne. Časť, ktorá sa používa z materského roztoku, sa musí prefiltrovať.
Aby sa zabránilo kontaminácii prípravku, odporúča sa prejsť časťou, ktorá sa bude nepretržite používať, na malú jantárovú fľašu s kvapkadlom. Nabite vždy, keď dôjde k vybitiu činidla.
Materiály na prípravu tlmivého roztoku
Na druhej strane sa roztok pufra pri pH 7,2 pripraví nasledujúcim spôsobom:
Odváži sa 6,77 g bezvodého fosforečnanu sodného (NaHPO4), 2,59 g dihydrogenfosforečnanu draselného (KH)2PO4) a destilovanej vody do 1000 cm3.
Konečná príprava farbiva
Na prípravu konečného farbiaceho roztoku sa zmerajú 2 cm3 prefiltrovaného zásobného roztoku a zmiešajú sa so 6 ml tlmivého roztoku. Zmes sa mieša.
Dôležitou skutočnosťou, ktorá sa musí brať do úvahy, je to, že techniky prípravy farbiva sa môžu meniť podľa komerčného domu.
Dodatočné materiály potrebné na vykonanie farbenia
Okrem opísaných materiálov by mal byť vybavený farebnými mostíkmi, vodnými clonami alebo puzdrom na umývanie, listami na predmety alebo kryty, stopkami na kontrolu časov sfarbenia a blotovacím papierom alebo nejakým materiálom, ktorý možno použiť na sušenie ( gáza alebo bavlna).
technika
Proces farbenia
1) Pred farbením musíte mať vzorku nanesenú na čisté podložné sklíčko..
Vzorky môžu byť krv, kostná dreň, rezy histologických tkanív alebo cerviko-vaginálne vzorky. Odporúča sa, aby boli vonkajšie strany tenké a pred farbením mali 1 až 2 hodiny sušenia.
2) Všetky listy, ktoré musíte zafarbiť, sú umiestnené na farebnom moste. Vždy pracujte v rovnakom poradí a identifikujte každý list dobre.
3) Na stierku naneste niekoľko kvapiek 100% metylalkoholu (metanol) a nechajte pôsobiť 3 až 5 minút, aby sa vzorka fixovala a dehydratovala..
4) Zlikvidujte metanol prítomný v liste a nechajte uschnúť na vzduchu.
5) Po vysušení umiestnite konečný roztok farbiva kvapkadlom, až kým sa celý list nepokryje. Nechajte pôsobiť 15 minút. Niektorí autori odporúčajú do 25 min. Záleží na komerčnom dome.
6) Farbivo vylejte a opláchnite destilovanou vodou alebo roztokom pufra 7.2.
7) Na blotting papier nechajte listy suché na čerstvom vzduchu, usporiadané zvisle pomocou podpory.
8) Utrite zadnú stranu diapozitívu gázou alebo bavlneným tampónom navlhčeným v alkohole, aby ste odstránili zvyšné farbivo.
utilities
Technika farbenia Giemsa sa používa v niekoľkých oblastiach: hematológia, mykológia, bakteriológia, parazitológia, cytológia a cytogenetika.
hematológie
Je to najčastejší nástroj, ktorý sa tomuto farbeniu dáva. S ním môžeme identifikovať každú z buniek prítomných vo vzorkách kostnej drene alebo periférnej krvi. Rovnako ako odhad počtu každej série, ktorý je schopný detegovať leukocytózu alebo leukopéniu, trombocytopéniu, atď..
Pretože je citlivá na identifikáciu nezrelých buniek, je dôležitá pri diagnostike akútnych alebo chronických leukémií. Je tiež možné diagnostikovať anémiu, ako je kosáčikovitá choroba, kosáčikovité ochorenie, okrem iného..
mykológia
V tejto oblasti je bežné používať ho na vyhľadávanie Histoplasma capsulatum (intracelulárna dimorfná huba) vo vzorkách tkaniva.
bakteriológie
V hematologických škvrnách zafarbených Giemsou je možné zistiť Borrelias sp u pacientov, ktorí majú ochorenie nazývané horúčka recidivujúca. Vo vzorkách odobratých vo febrilnom píku sa medzi erytrocytmi vyskytujú spirochety.
Je tiež možné vizualizovať intracelulárne baktérie ako Rickettsias sp a Chlamydia trachomatis v infikovaných bunkách.
parazitológia
V oblasti parazitológie farbenie Giemsa umožnilo diagnostiku parazitických ochorení, ako je malária, Chagasova choroba a leishmanióza..
V prvých dvoch parazitov Plasmodium sp a Trypanosoma cruzi môžu byť vizualizované v periférnej krvi infikovaných pacientov, môžu byť nájdené v rôznych štádiách podľa fázy, v ktorej je ochorenie \ t.
Na zlepšenie vyhľadávania krvných parazitov sa odporúča použiť Giemsa farbivo zmiešané s farbivom May-Grünwald.
Podobne, kožná leishmanióza môže byť diagnostikovaná pri hodnotení vzoriek kožných biopsií zafarbených Giemsom, kde sa nachádza parazit..
cytológia
Farbenie Giemsa sa tiež používa na cytologickú štúdiu endocervikálnych vzoriek, hoci na tento účel nie je najčastejšie používanou technikou..
Ale v prípadoch nedostatku zdrojov sa dá použiť, s funkčnosťou podobnou funkcii, ktorú ponúka technika Papanicolaou a za nižšiu cenu. Vyžaduje si to však expertízu zo strany skúšajúceho.
cytogenetika
Dôležitým znakom farbenia Giemsa je jeho schopnosť silne sa viazať na oblasti bohaté na adeníny DNA a tymíny. To umožňuje vizualizáciu DNA počas mitózy buniek v rôznych stavoch kondenzácie.
Tieto štúdie sú potrebné na detekciu chromatických aberácií, ako sú duplikácie, delécie alebo translokácie rôznych oblastí chromozómov..
Výskum demonštrujúci účinnosť farbenia Giemsa
Cannova a kol. (2016) porovnávali 3 techniky farbenia na diagnostiku kožnej leishmaniózy.
Na tento účel použili vzorky získané z pokusného zvieraťa (Mesocrisetus auratus) experimentálne inokulované Leishmanias.
Autori preukázali, že farbenie Giemsa bolo lepšie ako farbenie Pap-mart® a Gaffney. Preto sa domnievali, že Giemsa farbivo je ideálne na diagnostiku kožnej leishmaniózy.
Vynikajúce výsledky získané autormi sú v dôsledku kombinácie farbív, ktoré tvorí zmes Giemsa predstavuje podmienky potrebné pre vytvorenie priaznivého kontrast, čo umožňuje jasné rozlíšenie štruktúry amastigotes ako vo vnútri aj extracelulárne.
Ostatné techniky (Pap-mart® a Gaffney) to tiež urobili, ale slabším spôsobom, a preto bolo ťažké ich vizualizovať. Preto sa na parazitologické diagnostikovanie leishmaniózy odporúča farbenie Giemsa.
Podobne štúdia Ramíreza a kol. (1994) hodnotila platnosť Giemsovej a Lendrumovej škvrny v spojivových náteroch na identifikáciu Chlamydia trachomatis.
Autori zistili, že farbenie Giemsa a Ledrum má rovnakú špecifickosť, ale Giemsa bol citlivejší.
To vysvetľuje, prečo je v súčasnosti farbenie Giemsa najčastejšie používané na diagnostiku chlamýdiových infekcií, najmä ak je málo zdrojov..
Odporúčania pre dobré farbenie
Sušenie listov by sa nemalo urýchľovať. Je potrebné čakať na obozretný čas na jeho vyschnutie na čerstvom vzduchu. Približne 2 hodiny.
Pre dosiahnutie najlepších výsledkov okamžite po 2 hodinách.
Aby boli škvrny fixované a lepšie zafarbené, vzorka musí byť rozložená na hárku tak, aby zostala tenká a rovnomerná vrstva..
Uprednostňovanou vzorkou krvi je kapilára, pretože šmouha je vytvorená priamo z kvapky krvi, a preto vzorka nemá žiadnu prísadu, ktorá podporuje udržanie bunkových štruktúr..
Ak sa však používa venózna krv, EDTA sa má používať ako antikoagulant a nie heparín, pretože ten zvyčajne deformuje bunky..
Bežné chyby vo vyfarbení Giemsa
V praxi tohto sfarbenia môžu byť urobené chyby. Dôkazom toho sú náhle zmeny v odtieňoch štruktúr.
Extrémne modré sfarbenie
Môže to byť spôsobené:
- Veľmi hrubé škvrny
- Prekročenie času farbenia
- Príliš málo umývania.
- Použitie činidiel, ktoré sú vysoko nad neutrálnym pH (alkalické).
Za týchto podmienok sú farby týchto štruktúr skreslené, takže erytrocyty nie zafarbené ružové-lososa bude zelená, budú granule eozinofilov, ktoré by mali byť zafarbené červených tehál namodralý alebo šedá otočiť a tak ďalej vôli odchýlky v obvyklých tonalitách.
Príliš ružové sfarbenie
Môže to byť spôsobené:
- Nedostatočný čas farbenia.
- Dlhodobé alebo nadmerné umývanie.
- Zlé sušenie.
- Použitie veľmi kyslých činidiel.
V tomto konkrétnom prípade sa štruktúry, ktoré za normálnych okolností postriekal modrej ani zďaleka viditeľné, zatiaľ čo konštrukcie sú zafarbené ružové odtiene prehnané.
Príklad: erytrocyty so silnou jasne červenej alebo oranžovej farby, bude jadrový chromatín svetlo ružové a granuláty z eozinofilov sa zafarbia jasne červené intenzívny.
Prítomnosť precipitátov v nátere
Príčiny môžu byť:
- Používajte špinavé alebo zle umývané listy.
- Nedovoľte, aby sa náter dobre vysušil.
- Fixačný roztok nechajte príliš dlho.
- Nedostatočné premývanie na konci farbenia.
- Nedostatočná filtrácia alebo nefiltrovanie použitého farbiva.
Prítomnosť morfologických artefaktov
Morfologické artefakty sa môžu objaviť v náteroch, čo sťažuje vizualizáciu a interpretáciu prítomných štruktúr. Je to spôsobené:
- Typ použitého antikoagulačného činidla, ako je napríklad heparín.
- Použitie znečistených, poškodených alebo mastných listov.
Režim skladovania
Po príprave by sa farbivo malo uchovávať pri izbovej teplote (15 - 25 ° C), aby sa zabránilo zrážaniu farbiva. Musí sa skladovať v uzavretej jantárovej nádobe.
referencie
- Cannova D, Brito E a Simons M. Hodnotenie farebných techník na diagnostiku kožnej leishmaniózy. Salus. 2016; 20 (2): 24-29.
- Reagencie PanReac Applichem ITW. Giemsa farbivo. Verzia 2: JMBJUL17 CEIVD10ES. Castellar del Vallés, Španielsko.
- Clark G. Postupy farbenia (1981), 4th. Williams & Willkins.
- Aplikovaná klinická chémia Farbivo Giemsa na diagnostiku in vitro. Distribútor: cromakit.es
- Ramirez R, Mejia m, Garcia de la Riva J, F a Hermes Grazioso C Platnosť Giemsa a Lendrum v spojovky tampóny pre identifikáciu Chlamydia trachomatis. Bol Sanit Panam. 1994; 116 (3): 212-216.
- Casas-Rincon G. Všeobecná mykológia. 1994. 2. ed. Universidad Central de Venezuela, edície knižnice. Venezuela, Caracas.
- "Giemsa škvrna." Wikipédia, slobodná encyklopédia. 1 sep 2017, 01:02 UTC. 6. december 2018, en.wikipedia.org.


