Sulfid hlinitý (Al2S3) Chemická štruktúra, nomenklatúra, vlastnosti
sulfid hlinitý (Al2S3) je svetlosivá chemická zlúčenina tvorená oxidáciou kovového hliníka stratou elektrónov poslednej úrovne energie a stávajúc sa katiónom a redukciou nekovovej síry, získaním elektrónov získaných hliníkom a stávajúc sa anión.
Aby k tomu mohlo dôjsť a hliník môže priniesť svoje elektróny, je potrebné predložiť tri hybridné orbital sp3, ktoré poskytujú možnosť tvorby väzieb s elektrónmi zo síry.

Citlivosť sulfidu hlinitého na vodu znamená, že v prítomnosti vodnej pary vo vzduchu môže reagovať na výrobu hydroxidu hlinitého (Al (OH)).3), sírovodík (H2S) a vodík (H2) Plynu; ak sa tento akumulátor akumuluje, môže spôsobiť výbuch. Preto by malo byť balenie sulfidu hlinitého vyrobené pomocou vzduchotesných nádob.
Na druhej strane, pretože sulfid hlinitý má reaktivitu s vodou, robí z neho prvok, ktorý nemá rozpustnosť v uvedenom rozpúšťadle.
index
- 1 Chemická štruktúra
- 1.1 Molekulový vzorec
- 1.2 Štruktúrny vzorec
- 2 Vlastnosti
- 2.1 Fyzikálne vlastnosti
- 2.2 Chemické vlastnosti
- 3 Použitie a aplikácie
- 3.1 V superkondenzátoroch
- 3.2 V sekundárnych lítiových batériách
- 4 Riziká
- 4.1 Postup prvej pomoci
- 4.2 Protipožiarne opatrenia
- 5 Referencie
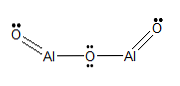
Chemická štruktúra
Molekulový vzorec
na2S3
Štruktúrny vzorec
- Sulfid hlinitý.
- Trisulfid hlinitý.
- Sulfid hlinitý (III).
- Sulfid hlinitý.
vlastnosti
Chemické zlúčeniny väčšinou vykazujú dva druhy vlastností: fyzikálne a chemické.
Fyzikálne vlastnosti
Molárna hmotnosť
150,158 g / mol
hustota
2,02 g / ml
Teplota topenia
1100 ° C
Rozpustnosť vo vode
neriešiteľný
Chemické vlastnosti
Jednou z hlavných reakcií sulfidu hlinitého je voda, ako substrát alebo hlavné činidlo:

Pri tejto reakcii je možné pozorovať tvorbu hydroxidu hlinitého a sírovodíka, ak je vo forme plynu alebo sírovodíka, ak je rozpustený vo vode ako roztok. Jeho prítomnosť je identifikovaná vôňou zhnitých vajec.
Použitie a aplikácie
V superkondenzátoroch
Sulfid hlinitý sa používa pri výrobe nano sieťových štruktúr, ktoré zlepšujú špecifickú povrchovú plochu a elektrickú vodivosť takým spôsobom, že sa dá dosiahnuť vysoká kapacitancia a hustota energie, ktorých použiteľnosťou je schopnosť superkondenzátorov..
Grafén oxid (GO) - grafén je jednou z aloropických foriem uhlíka - slúžil ako podpora pre sulfid hlinitý (Al2S3) s hierarchickou morfológiou podobnou nano-montane vyrobenej hydrotermálnou metódou.
Účinok grafénoxidu
Charakteristiky grafénového oxidu ako nosiča, ako aj vysoká elektrická vodivosť a povrchová plocha robia nanorambutant Al2S3 sú elektrochemicky aktívne.
CV špecifické kapacitné krivky s dobre definovanými redox píkmi potvrdzujú pseudo-kapacitné správanie nanorambutanov Al2S3 hierarchické, udržiavané v oxidoch grafénu v 1M NaOH elektrolytu. Špecifické hodnoty CV kapacity získané z kriviek sú: 168,97 pri rýchlosti skenovania 5 mV / s.
Okrem toho bol pozorovaný dobrý čas galvanostatického výboja 903 μs, veľká špecifická kapacita 2178,16 pri prúdovej hustote 3 mA / Cm2. Hustota energie vypočítaná z galvanostatického výboja je 108,91 Wh / Kg pri prúdovej hustote 3 mA / Cm2.
Elektrochemická impedancia tak potvrdzuje pseudo-kapacitnú povahu hierarchickej nano-kolibrujúcej elektródy Al2S3. Test stability elektródy vykazuje 57,44% retenciu špecifickej kapacity až 1000 cyklov.
Experimentálne výsledky naznačujú, že nanorambutant Al2S3 Hierarchické je vhodné pre superkondenzátorové aplikácie.
V sekundárnych lítiových batériách
S cieľom vyvinúť lítiovú sekundárnu batériu s vysokou hustotou energie, sulfid hlinitý (Al2S3) ako aktívny materiál.
Počiatočná prietoková kapacita meraná od Al2S3 bola približne 1170 mAh g-1 pri 100 mA g-1. To zodpovedá 62% teoretickej kapacity pre síru.
Al2S3 vykazovali nízku retenciu kapacity v rozsahu potenciálov medzi 0,01 V a 2,0 V, hlavne kvôli štrukturálnej ireverzibilite procesu nabíjania alebo extrakcie Li..
Analýzy XRD a K-XANES pre hliník a síru ukázali, že povrch Al2S3 reaguje reverzibilne počas procesov nakladania a vykladania, zatiaľ čo Al jadro2S3 ukázali štrukturálnu ireverzibilitu, pretože LiAl a Li2S boli vytvorené z Al2S3 v počiatočnom stiahnutí a potom zostali tak, ako boli.
riziká
- Pri kontakte s vodou uvoľňuje horľavé plyny, ktoré môžu samovoľne horieť.
- Spôsobuje podráždenie pokožky.
- Spôsobuje vážne podráždenie očí.
- Môže spôsobiť podráždenie dýchacích ciest.
Informácie sa môžu medzi oznámeniami líšiť v závislosti od nečistôt, prísad a iných faktorov.
Postup prvej pomoci
Všeobecné ošetrenie
Ak príznaky pretrvávajú, vyhľadajte lekársku pomoc.
Špeciálne ošetrenie
nikto
Dôležité príznaky
nikto
inhalácia
Vezmite obeť vonku. Dodávajte kyslík, ak je dýchanie ťažké.
požití
Podajte jedno alebo dve poháre vody a vyvolajte zvracanie. Osobe v bezvedomí nikdy nevyvolávajte zvracanie ani dávajte nič ústami.
koža
Umyte postihnuté miesto vodou a jemným mydlom. Odstráňte kontaminovaný odev.
oči
Umyte si oči vodou, často bliká niekoľko minút. Ak sú prítomné kontaktné šošovky, vyplachujte ich.
Protipožiarne opatrenia
zápalnosť
Nehorľavý.
Hasiace prostriedky
Reaguje s vodou. Nepoužívajte vodu: použite CO2, piesok a hasiaci prášok.
Postup boja
Použite úplný dýchací prístroj s plnou ochranou. Noste oblečenie, aby sa zabránilo kontaktu s pokožkou a očami.
referencie
- Salud y Riesgos.com, (s.f), Definícia, pojmy a články o zdraví, rizikách a životnom prostredí. Obnovené: saludyriesgos.com
- Sulfid hlinitý. (S.f). Na stránke Wikiwand. Získané dňa 9. marca 2018: wikiwand.com
- Webové prvky (S.f) .Dialuminium Trisulpfide, obnovené 10. marca 2018: webelements.com
- Iqbal, M., Hassan, M., M., Bibi.S., Parveen, B. (2017). Vysoká špecifická kapacita a hustota energie syntetizovanej hierarchickej štruktúry Al2S3 nanorambutanu na báze grafénového oxidu pre aplikáciu superkapacitora, Electrochimica Acta, Zväzok 246 ,Strany 1097-1103
- Senoh, H., Takeuchi, T., Hiroyuki K., Sakaebe, H., M., Nakanishi, K., Ohta, T., Sakai, T., Yasuda, K. (2010). Elektrochemické vlastnosti sulfidu hlinitého na použitie v lítiu.Časopis zdrojov energie,Zväzok 195, Číslo 24, strany 8327-8330 doi.org
- LTS Research Laboratories, Inc (2016), Karta bezpečnostných údajov Sulfid hliníka: ltschem.com