Vlastnosti dvojchrómanu sodného, výroba, riziká a použitia
dvojchróman sodný "Anorganická zlúčenina všeobecného vzorca Na2Cr207" je anorganická zlúčenina všeobecného vzorca Na2Cr207. Je to jedna z mnohých zlúčenín šesťmocného chrómu (Cr VI). Jeho štruktúra je znázornená na obrázku 1, hoci sa s ňou zvyčajne zaobchádza v dihydrátovanej forme, ktorej vzorcom je Na2Cr2O7H20..
Má dve iónové väzby medzi molekulami sodíka a záporne nabitými kyslíkami. Chrómová ruda sa extrahuje z dvojchrómanu sodného. Ročne sa vyrábajú milióny kilogramov dvojchrómanu sodného.
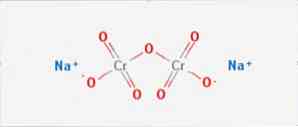
Čína je najväčším výrobcom dvojchrómanu sodného, avšak čínske chemické závody majú relatívne nízku produkciu, menej ako 50 000 ton ročne, v porovnaní s továrňou v Kazachstane, ktorá vyrába viac ako 100 000 ton ročne..
Rastliny v Rusku, Spojených štátoch a Spojenom kráľovstve majú strednú produkciu medzi 50 000 a 100 000 ton ročne (Kogel, 2006).
Z hľadiska reaktivity a vzhľadu má dvojchróman sodný podobné vlastnosti ako dvojchróman draselný, avšak sodná soľ je rozpustnejšia vo vode a má hmotnostný ekvivalent menší ako draselná soľ..
Dvojchróman sodný vytvára pri zahrievaní toxické výpary chrómu. Je to silné oxidačné činidlo a je vysoko korozívne.
Táto zlúčenina sa nachádza v zdrojoch pitnej vody kontaminovaných rôznymi priemyselnými postupmi, ako sú galvanizačné alebo galvanické techniky, opaľovanie kože a textilná výroba..
index
- 1 Fyzikálne a chemické vlastnosti
- 2 Výrobné metódy
- 3 Reaktivita a nebezpečenstvá
- 4 Použitie a aplikácie
- 5 Biochémia
- 6 Referencie
Fyzikálne a chemické vlastnosti
Dvojchróman sodný sa skladá z kryštálov s červeno-oranžovou monoklinickou štruktúrou v bezvodej forme a bez zápachu. Jeho molekulová hmotnosť je 261,97 g / mol v bezvodej forme a 298,00 g / mol vo svojej dihydrátovanej forme..
Má bod topenia 356,7 stupňov Celzia, bod varu 400 stupňov Celzia, v ktorom sa rozkladá. Má hustotu 2,52 g / ml.

Obrázok 2 ukazuje vzhľad dvojchrómanu sodného. Jeho rozpustnosť vo vode je 187 g na 100 gramov pri 25 ° C a jej rozpustnosť v etanole je 513,2 gramov na liter pri 19,4 ° C (National Center for Biotechnology Information, s.f.)..
Považuje sa za stabilnú zlúčeninu, ak sa skladuje za odporúčaných podmienok a nie je horľavý. Pretože je to silné oxidačné činidlo, je korozívne a v roztoku je kyselina, ktorá má schopnosť znížiť pH na 4 v roztoku 1% hmotn./obj..
Výrobné metódy
Chróman sodný sa môže konvertovať na dichróman kontinuálnym procesom, ktorý spracováva kyselinou sírovou, oxidom uhličitým alebo ich kombináciou..
Odparenie roztoku dvojchrómanu sodného spôsobí vyzrážanie síranu sodného a / alebo hydrogenuhličitanu sodného a tieto zlúčeniny sa odstránia pred konečnou kryštalizáciou dvojchrómanu sodného..
Dvojchróman sodný sa môže vykonať v trojstupňovom procese:
- Alkalické praženie chromitových oxidačných podmienok
- Lúhovanie. Extrakcia rozpustnej látky zo zmesi pôsobením kvapalného rozpúšťadla
- Konverzia monochromátu sodného v dvojchrómanu sodnom pomocou kyseliny.
Bezvodý dvojchróman sodný sa môže pripraviť roztavením dihydrátu dihydrátu sodného, kryštalizáciou vodných roztokov dichrómanu nad 86 ° C alebo sušením roztokov dvojchrómanu sodného v sušičkách..
Roztoky dvojchrómanu sodného s koncentráciou 69 a 70% hmotn./obj. Sa používajú ako pohodlný a cenovo výhodný spôsob odosielania množstiev, čím sa predchádza nutnosti ručnej manipulácie alebo rozpúšťania kryštálov.
Reaktivita a nebezpečenstvá
Je to silné oxidačné činidlo. Nekompatibilný so silnými kyselinami. Kontakt s horľavými materiálmi môže spôsobiť požiar. V prítomnosti tepla alebo ohňa sa môžu tvoriť toxické výpary oxidu chrómu.
Známa "zmes kyseliny chrómovej" dichrómanu a kyseliny sírovej s organickými zvyškami spôsobuje prudkú exotermickú reakciu. Táto zmes v kombinácii s acetónovými zvyškami tiež vedie k prudkej reakcii.
Kombinácia dichrómanu a kyseliny sírovej s alkoholmi, etanolom a 2-propanolom vedie k prudkej exotermnej reakcii. Vzhľadom na výskyt mnohých prípadov zahŕňajúcich zmiešanie kyseliny dichróman-sírová s oxidovateľnými organickými materiálmi je pravdepodobne najlepšie vyhnúť sa takýmto interakciám..
Kombinácia dichrómanu s hydrazínom je výbušná, dá sa očakávať, že dichromátová reakcia bude s amínmi všeobecne silná. Prídavok dehydratovanej dvojchrómanovej soli k anhydridu kyseliny octovej vedie k konečnej exotermnej reakcii.
Bór, kremík a dichrómany tvoria pyrotechnické zmesi. Zmes kyseliny octovej, 2-metyl-2-pentenalu a dichromanu vedie k prudkej reakcii (Chemical Datasheet Sodium Dichromate., 2016).
Vdýchnutie prachu alebo hmly spôsobuje podráždenie dýchacích ciest, ktoré sa niekedy podobá astme. Môže sa vyskytnúť septálna perforácia. Považuje sa za jed.
Požitie spôsobuje zvracanie, hnačku a veľmi neobvykle komplikácie žalúdka a obličiek. Kontakt s očami alebo pokožkou spôsobuje miestne podráždenie. Opakovaná expozícia pokožke spôsobuje dermatitídu.
Dvojchróman sodný je karcinogén u ľudí. Existuje dôkaz, že zlúčeniny šesťmocného chrómu alebo Cr (VI) môžu u ľudí spôsobiť rakovinu pľúc. Ukázalo sa, že dvojchróman sodný spôsobuje rakovinu pľúc u zvierat.
Hoci dvojchróman sodný nebol identifikovaný ako teratogénna zlúčenina alebo reprodukčné riziko, je známe, že zlúčeniny šesťmocného chrómu alebo Cr (VI) sú teratogénne a spôsobujú reprodukčné poškodenie, ako je zníženie fertility a zasahovanie do menštruačných cyklov..
Dvojchróman sodný môže spôsobiť poškodenie pečene a obličiek, preto sa musí liečiť s mimoriadnou starostlivosťou (New Jersey Department of Health, 2009).
V prípade požitia by obeť mala piť vodu alebo mlieko; nikdy nevyvolávajte zvracanie. V prípade kontaktu s pokožkou alebo očami sa má postupovať ako s kyselými popáleninami; Oči vypláchnite vodou najmenej 15 minút.
Vonkajšie lézie sa môžu trieť 2% roztokom tiosíranu sodného. Vo všetkých prípadoch by sa mal konzultovať s lekárom.
Použitie a aplikácie
Okrem svojho významu pri výrobe iných chrómových chemikálií má dvojchróman sodný tiež mnoho priamych použití ako zložka pri výrobe:
- Kovová povrchová úprava: pomáha odolávať korózii a čistí kovové povrchy, tiež podporuje priľnavosť farby.
- Organické produkty: používajú sa ako oxidačné činidlá pri výrobe produktov, ako sú vitamín K a vosk.
- Pigmenty: používajú sa pri výrobe anorganických chromátových pigmentov, kde produkujú rad farieb stabilných voči svetlu. Niektoré druhy chrómanu sa tiež používajú ako inhibítory korózie v spodných vrstvách a primeroch.
- Keramika: používa sa na prípravu farebných skiel a keramických glazúr.
- Textil: používa sa ako moridlo pre kyslé farbivá na zlepšenie jeho rýchlofarebných vlastností.
- Výroba síranu chrómu.
(Dvojchróman sodný, stavebný blok pre prakticky všetky ostatné zlúčeniny chrómu, 2010-2012)
Dihydrát dvojchrómanu sodného, jeho použitie je ideálne v rôznych podmienkach vrátane vysokoteplotných aplikácií, ako sú keramické glazúry a farebné sklo..
Oxid chrómový, ktorý je tvrdší ako iné oxidy kovov, ako napríklad titán alebo železo, je ideálny pre prostredia, kde sú teploty a prevádzkové podmienky agresívne..
Táto látka sa používa hlavne na výrobu iných zlúčenín chrómu, ale používa sa aj v bentonitových kaloch používaných pri výrobe oleja, v prostriedkoch na ochranu dreva, pri výrobe organických chemikálií a ako inhibítor korózie..
Keď sa zmieša s hliníkom a dichrómanom draselným, oxidom chrómovým sa pri použití alumino-termického procesu vyrába kovový chróm vysokej čistoty. Toto je dôležitá zložka pri výrobe vysoko výkonných superzliatin používaných v leteckom a kozmickom priemysle.
Pri organickej syntéze sa dvojchróman sodný používa ako oxidačné činidlo pri redukčných oxidových reakciách v prítomnosti kyseliny sírovej.
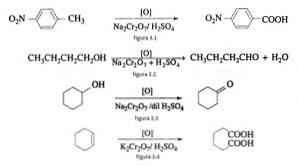
Napríklad oxidácia p-nitrotoluénu za vzniku kyseliny p-nitrobenzoovej, pri oxidácii n-butanolu za vzniku n-butaldehydu, pri tvorbe cyklohexanónu z cyklohexanolu a pri tvorbe kyseliny adipovej podľa obrázkov 3.1. 3.2, 3.3 a 3.4 (VK Ahluwalia, 2004).
biochémie
Intratracheálna instilácia dvojchrómanu sodného (CrVI) a hydroxidu octanu chromitého (CrIII) u samcov potkanov viedla k zvýšeniu koncentrácií chrómu v celej krvi, plazme a moči až do 72 hodín po expozícii; Maximálne koncentrácie boli dosiahnuté 6 hodín po expozícii.
Pomer medzi celkovým obsahom chrómu v krvi a plazmatických koncentrácií chrómu bol významne odlišný pri ošetreniach Cr (VI) a Cr (III). Na vyhodnotenie expozície chrómu by sa preto mali použiť analýzy chrómu v krvi a chrómu v plazme.
Chróm bol tiež detegovaný v periférnych lymfocytoch. Cr (VI), ale nie Cr (III) sa po liečbe významne akumuloval v lymfocytoch. Tieto bunky majú potenciál byť použité ako biomarkery pri hodnotení expozície zlúčeninám chrómu (Hooth, 2008).
referencie
- Chemický dátový list Dichromát sodný. (2016). Získané z chemikálií cameo :icalochemicals.noaa.
- Hooth, M. J. (2008). Technická správa o toxikologických a karcinogénnych štúdiách dihydrátu dvojchrómanu sodného. Národný inštitút zdravia USA.
- Kogel, J. E. (2006). Priemyselné minerály a skaly: Komodity, trhy, a používa siedme vydanie. littleton colorado: spoločnosť baníctva, hutníctva a prieskumu vč.
- Národné centrum pre informácie o biotechnológiách. (N. D.). PubChem Compound Database; CID = 25408. Zdroj: pubchem.com: pubchem.ncbi.nlm.nih.gov.
- Ministerstvo zdravotníctva v New Jersey. (2009, november). list nebezpečný pre látky toxické látky dvojchróman sodný. Zdroj: nj.gov: nj.gov.
- Dvojchróman sodný. Stavebný blok pre prakticky všetky ostatné zlúčeniny chrómu. (2010-2012). Zdroj: elementis chromium: elementischromium.com
- K. Ahluwalia, R. A. (2004). Komplexná praktická organická chémia: Prípravy a kvantitatívne analýzy. Delhi: Univerzitná tlač (India).


