Chlorid cínu (SnCl2) Vlastnosti, štruktúra, použitie a riziká
chlorid cínatý (II) alebo chlorid cínatý, chemického vzorca SnCl2, je biela kryštalická tuhá zlúčenina, produkt reakcie cínu a koncentrovaného roztoku kyseliny chlorovodíkovej: Sn (s) + 2HCl (konc.) => SnCl2(aq) + H2(G). Spôsob jeho syntézy (príprava) spočíva v pridaní kúskov cínových piluliek na reakciu s kyselinou.
Po pridaní kúskov cínu sa uskutočňuje dehydratácia a kryštalizácia až do získania anorganickej soli. V tejto zlúčenine cín stratil dva elektróny zo svojho valenčného plášťa za vzniku väzieb s atómami chlóru.
To možno lepšie pochopiť, ak vezmeme do úvahy valenčnú konfiguráciu cínu (5s)25px2pa0pz0), z ktorých pár elektrónov zaberá orbitál px sa podáva protónom H+, aby sa vytvorila diatomická molekula vodíka. To znamená, že ide o reakciu redoxného typu.
index
- 1 Fyzikálne a chemické vlastnosti
- 1.1 Valencia
- 1.2 Reaktivita
- 1.3 Redukčná činnosť
- 2 Chemická štruktúra
- 3 Použitie
- 4 Riziká
- 5 Referencie
Fyzikálne a chemické vlastnosti
Spojky SnCl2 Sú iónové alebo kovalentné? Fyzikálne vlastnosti chloridu cínatého vylučujú prvú možnosť. Teploty topenia a varu pre túto zlúčeninu sú 247 ° C a 623 ° C, čo svedčí o slabých intermolekulových interakciách, čo je bežný fakt pre kovalentné zlúčeniny..
Jeho kryštály sú biele, čo sa prejavuje ako nulová absorpcia vo viditeľnom spektre.
Valencia
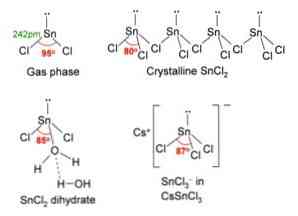
Na obrázku hore, v ľavom hornom rohu, je znázornená izolovaná molekula SnCl2.
Molekulárna geometria by mala byť plochá, pretože hybridizácia centrálneho atómu je sp2 (3 orbital sp2 a čistý p orbitál na vytvorenie kovalentných väzieb), ale voľný pár elektrónov zaberá objem a tlačí atómy chlóru nadol, čo dáva molekule uhlovú geometriu.
V plynnej fáze je táto zlúčenina izolovaná, takže neinteraguje s inými molekulami.
Ako strata dvojice elektrónov v orbitáli px, cín sa transformuje na ión Sn2+ a jeho výsledná elektronická konfigurácia je 5s25px0pa0pz0, so všetkými svojimi p orbitálmi, aby mohli prijímať odkazy z iných druhov.
Ióny Cl- súradnice s iontom Sn2+ za vzniku chloridu cínatého. Elektronická konfigurácia cínu v tejto soli je 5s25px2pa2pz0, schopnosť prijať ďalší pár elektrónov vo svojom voľnom orbitáli pz.
Môžete napríklad prijať ďalší ión Cl-, vytvorenie komplexu trigonálnej rovinnej geometrie (pyramídy s trojuholníkovou základňou) a záporne nabitého [SnCl3]-.
reaktivita
SnCl2 má vysokú reaktivitu a tendenciu správať sa ako Lewisova kyselina (elektrónový receptor) na dokončenie svojho valenčného oktetu.
Rovnako ako prijíma ión Cl-, to isté sa deje s vodou, ktorá "hydratuje" atóm cínu spojením molekuly vody priamo s cínom a druhá molekula vody vytvára interakcie vodíkovej väzby s prvou molekulou..
Výsledkom je, že SnCl2 nie je čistý, ale je koordinovaný s vodou vo svojej dihydrátovanej soli: SnCl22H2O.
SnCl2 Je veľmi rozpustný vo vode a v polárnych rozpúšťadlách, pretože je to polárna zlúčenina. Avšak jeho rozpustnosť vo vode, nižšia ako jeho hmotnostná hmotnosť, aktivuje hydrolytickú reakciu (prasknutie molekuly vody) na vytvorenie zásaditej a nerozpustnej soli:
SnCl2(aq) + H2O (l) <=> Sn (OH) Cl (s) + HCl (aq)
Dvojitá šípka označuje, že sa ustálila rovnováha, zvýhodnená vľavo (smerom k reaktantom), ak sa zvýšili koncentrácie HCl. Na tento účel sa použili roztoky SnCl2 majú kyslé pH, aby sa zabránilo vyzrážaniu nežiaduceho soľného produktu hydrolýzy.
Redukčná aktivita
Reaguje s kyslíkom vo vzduchu za vzniku chloridu cínatého alebo chloridu ciničitého:
6 SnCl2(aq) + O2(g) + 2H20 (l) => 2SnCl4(aq) + 4Sn (OH) Cl (s)
V tejto reakcii cín oxiduje za vzniku väzby s elektronegatívnym atómom kyslíka a zvyšuje počet väzieb s atómami chlóru.
Vo všeobecnosti elektronegatívne atómy halogénov (F, Cl, Br a I) stabilizujú väzby zlúčenín Sn (IV) a táto skutočnosť vysvetľuje, prečo SnCl2 je to redukčné činidlo.
Keď oxiduje a stráca všetky svoje valenčné elektróny, Sn ión4+ zostane s konfiguráciou 5s05px0pa0pz0, je to dvojica elektrónov v orbitáli 5s najťažšie byť "vytrhnutý".
Chemická štruktúra
SnCl2 predstavuje kryštálovú štruktúru ortorombického typu, podobnú radom píl, v ktorých hroty zubov sú chloridy.
Každý riadok je reťazec SnCl3 vytvorenie Cl mostíka s iným atómom Sn (Cl-Sn (Cl)2-Cl- ···), ako je vidieť na obrázku vyššie. Dva reťazce, spojené slabými interakciami typu Sn-Cl, tvoria jednu vrstvu usporiadania, ktorá je navrstvená na inú vrstvu, a tak ďalej, až kým sa kryštalická pevná látka nedefinuje..
Pár voľných elektrónov 5s2 spôsobí skreslenie štruktúry, pretože zaberá objem (objem elektronického oblaku).
Sn môže mať koordinačné číslo rovné deviatim, ktoré je rovnaké ako deväť susedov, pričom kreslí trigonálny hranol, ktorý sa nachádza v strede geometrického útvaru a Cl vo vrcholoch, okrem iných Cl umiestnených v každom z nich. štvorcových plôch hranolu.
Toto je ľahšie pozorovateľné, ak vezmeme do úvahy reťazec, kde Sn (tmavo sivé guľôčky) smerujú nahor a tri Cl spojené s ním tvoria trojuholníkovú podlahu, zatiaľ čo tri horné Cls tvoria trojuholníkovú strechu.
aplikácie
V organickej syntéze sa používa ako redukčné činidlo pre aromatické nitrozlúčeniny (Ar-NO.)2 Ar-NH2). Keďže jej chemická štruktúra je laminárna, nachádza uplatnenie vo svete katalýzy organických reakcií, okrem toho, že je potenciálnym kandidátom na katalytickú podporu..
Jeho redukčné vlastnosti sa používajú na stanovenie prítomnosti zlúčenín zlata, na poťahovanie skiel striebornými zrkadlami a na pôsobenie ako antioxidant.
Tiež vo svojej molekulárnej geometrii trigonálnej pyramídy (: SnX3- M+) sa používa ako Lewisova báza na syntézu veľkého počtu zlúčenín (ako je komplex Pt klastra).3sn8cl20, kde pár bez elektrónov je koordinovaný s Lewisovou kyselinou).
riziká
SnCl2 Môže poškodiť biele krvinky. Je korozívna, dráždivá, karcinogénna a má vysoké negatívne vplyvy na druhy, ktoré obývajú morské ekosystémy.
Pri vysokých teplotách sa môže rozkladať a uvoľňovať škodlivý plynný chlór. Pri kontakte s vysoko oxidačnými činidlami spúšťa výbušné reakcie.
referencie
- Shiver & Atkins. (2008). Anorganická chémia v Prvky skupiny 14 (štvrté vydanie, strana 329). Mc Graw Hill.
- ChemicalBook. (2017). Zdroj: marec 21, 2018, od ChemicalBook: chemicalbook.com
- PubChem. (2018). Chlorid cínu. Získané 21. marca 2018, z PubChem: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2017). Chlorid cínatý. Získané dňa 21. marca 2018, z Wikipédie: sk.wikipedia.org
- E. G. Rochow, E. W. (1975). Chémia germánia: cín a olovo (prvé vydanie). p-82,83. Pergamom Press.
- F. Hulliger. (1976). Štrukturálna chémia fázových fáz. P-120121. Vydavateľská spoločnosť D. Reidel.



