Typy ketónov, vlastnosti, nomenklatúra, použitia a príklady
ketóny sú to organické zlúčeniny, ktoré majú karbonylovú skupinu (-CO). Sú to jednoduché zlúčeniny, v ktorých je uhlík karbonylovej skupiny viazaný na dva atómy uhlíka (a ich substitučné reťazce). Ketóny sú "jednoduché", pretože nemajú reaktívne skupiny ako -OH alebo -Cl pripojené k uhlíku.
Nakoniec, eliminácia ketónov z ľudského tela je zvyčajne spojená s nízkou hladinou cukru (pri diabetických prípadoch a / alebo extrémnom pôste), čo môže spôsobiť vážne zdravotné problémy pre pacienta..
index
- 1 Všeobecný vzorec ketónov
- 2 Typy ketónov
- 2.1 Podľa štruktúry vášho reťazca
- 2.2 Podľa symetrie jeho radikálov
- 2.3 Podľa nasýtenia jeho radikálov
- 2.4 Diketóny
- 3 Fyzikálne a chemické vlastnosti ketónov
- 3.1 Teplota varu
- 3.2 Rozpustnosť
- 3.3 Kyslosť
- 3.4 Reaktivita
- 4 Nomenklatúra
- 5 Rozdiel medzi aldehydmi a ketónmi
- 6 Priemyselný a každodenný život
- 7 Príklady ketónov
- 7.1 Butanón (C4H8O)
- 7,2 cyklohexanón (C6H10O)
- 7.3 Testosterón (C19H22O2)
- 7,4 Progesterón (C21H30O2)
- 8 Referencie
Všeobecný vzorec ketónov
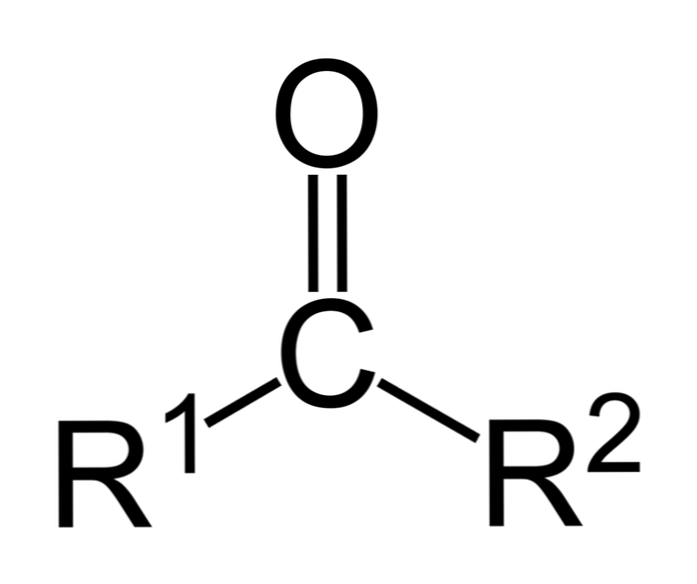
Ketóny sú karbonylové zlúčeniny, v ktorých je táto skupina viazaná na dve uhľovodíkové skupiny; tieto môžu byť alkylové skupiny, benzénové kruhové skupiny alebo obidva.
Ketón môže byť jednoducho reprezentovaný ako R- (C = O) -R ', kde R a R' sú akékoľvek dva uhľovodíkové reťazce (alkány, alkény, alkíny, cykloalkány, benzénové deriváty a ďalšie). K karbonylovej skupine nie sú pripojené žiadne ketóny s vodíkom.
Existuje široká škála spôsobov prípravy ketónov v priemyselnom a laboratórnom prostredí; Okrem toho je dôležité poznamenať, že ketóny môžu byť syntetizované rôznymi organizmami, vrátane ľudí.
V priemysle je najbežnejšou metódou syntézy ketónov oxidácia uhľovodíkov, typicky s použitím vzduchu. V malom meradle sa ketóny zvyčajne pripravujú oxidáciou sekundárnych alkoholov, čo dáva ako produkty ketón a vodu.
Okrem týchto najbežnejších metód možno ketóny syntetizovať prostredníctvom alkénov, alkínov, solí dusíkatých zlúčenín, esterov a mnohých ďalších zlúčenín, vďaka čomu sa dajú ľahko získať..
Typy ketónov
Pre ketóny existuje niekoľko klasifikácií, najmä v závislosti od substituentov v ich reťazcoch R. Nasledujú najbežnejšie klasifikácie týchto látok:
Podľa štruktúry vášho reťazca
V tomto prípade je ketón klasifikovaný spôsobom, akým je štruktúrovaný jeho reťazec: alifatické ketóny sú tie, ktoré majú dva zvyšky R a R ', ktoré majú formu alkylových radikálov (alkány, alkény, alkíny a cykloalkány)..
Aromatické látky sú tie, ktoré tvoria benzénové deriváty, pričom sú stále ketónmi. Nakoniec, zmesné ketóny sú tie, ktoré majú R alkylový radikál a R 'arylový radikál, alebo naopak.
Podľa symetrie jeho radikálov
V tomto prípade sa študujú radikály R a R 'substituenty karbonylovej skupiny; keď sú rovnaké (identické), ketón sa nazýva symetrický; ale keď sú iné (ako väčšina ketónov), nazýva sa to asymetrické.
Podľa nasýtenia jeho radikálov
Ketóny môžu byť tiež klasifikované podľa nasýtenia svojich uhlíkových reťazcov; Ak sú vo forme alkánov, ketón sa nazýva nasýtený ketón. Naopak, ak sa reťazce nachádzajú ako alkény alebo alkíny, ketón sa nazýva nenasýtený ketón.
diketony
Toto je samostatná trieda ketónov, pretože reťazce tohto ketónu majú vo svojej štruktúre dve karbonylové skupiny. Niektoré z týchto ketónov majú jedinečné vlastnosti, ako je dlhšia dĺžka väzby medzi uhlíkmi.
Napríklad diketóny odvodené od cyklohexánu sú známe ako chinóny, ktoré sú iba dve: orto-benzochinón a para-benzochinón.
Fyzikálne a chemické vlastnosti ketónov
Ketóny, podobne ako väčšina aldehydov, sú kvapalné molekuly a majú rad fyzikálnych a chemických vlastností, ktoré sa líšia v závislosti od dĺžky ich reťazcov. Jeho vlastnosti sú opísané nižšie:
Teplota varu
Ketóny sú vysoko prchavé, vysoko polárne a nemôžu darovať vodíky pre vodíkové väzby (nemajú vodíkové atómy pripojené k ich karbonylovej skupine), takže majú vyššie teploty varu ako alkény a étery, ale nižšie ako tie, alkoholy s rovnakou molekulovou hmotnosťou.
Teplota varu ketónu sa zvyšuje so zvyšujúcou sa veľkosťou molekuly. Je to kvôli zásahu van der Waalsových síl a dipólovo-dipólových síl, ktoré vyžadujú väčšie množstvo energie na oddelenie atómov a elektrónov priťahovaných k molekule..
rozpustnosť
Rozpustnosť ketónov má silný vplyv čiastočne na schopnosť týchto molekúl prijímať vodíky v ich kyslíkovom atóme a tak vytvárať vodíkovú väzbu s vodou. Okrem toho sa medzi ketónmi a vodou vytvárajú atraktívne, rozptylové a dipólové dipólové sily, ktoré zvyšujú ich rozpustný účinok.
Ketóny strácajú kapacitu rozpustnosti, čím väčšia je ich molekula, pretože začínajú vyžadovať viac energie na rozpustenie vo vode. Sú tiež rozpustné v organických zlúčeninách.
kyslosť
Vďaka svojej karbonylovej skupine majú ketóny kyslú povahu; toto sa deje kvôli schopnosti rezonančnej stabilizácie tejto funkčnej skupiny, ktorá môže prenášať protóny z jej dvojitej väzby za vzniku konjugovanej bázy nazývanej enol.
reaktivita
Ketóny sú súčasťou veľkého počtu organických reakcií; toto nastáva v dôsledku citlivosti jeho karbonylového uhlíka na nukleofilnú adíciu, okrem polarity tohto.
Ako je uvedené vyššie, vysoká reaktivita ketónov z nich robí uznávaný medziprodukt, ktorý slúži ako základ pre syntézu ďalších zlúčenín.
názvoslovie
Ketóny sú pomenované podľa priority alebo dôležitosti karbonylovej skupiny v celej molekule, takže keď máte molekulu riadenú karbonylovou skupinou, ketón je pomenovaný pridaním prípony "-one" k názvu uhľovodíka..
Najdlhší reťazec s karbonylovou skupinou je braný ako hlavný reťazec a potom je molekula pomenovaná. Ak karbonylová skupina nemá prednosť pred ostatnými funkčnými skupinami molekuly, potom je identifikovaná s "-oxo".
Pre komplikovanejšie ketóny môže byť poloha funkčnej skupiny identifikovaná číslom a v prípade diketónov (ketóny s dvomi identickými R a R 'substituentmi) je uvedená molekula s príponou "-dion"..
Nakoniec, slovo "ketón" môže byť tiež použité po identifikácii reťazcov radikálov pripojených k karbonylovej funkčnej skupine.
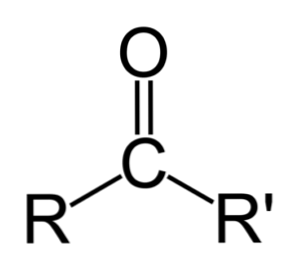
Rozdiel medzi aldehydmi a ketónmi
Najväčší rozdiel medzi aldehydmi a ketónmi je prítomnosť atómu vodíka viazaného na karbonylovú skupinu v aldehydoch.
Tento atóm má dôležitý účinok, pokiaľ ide o zahrnutie molekuly do oxidačnej reakcie: aldehyd vytvorí karboxylovú kyselinu alebo soľ karboxylovej kyseliny v závislosti od toho, či k oxidácii dochádza za kyslých alebo bázických podmienok..
Na rozdiel od toho ketón nemá tento vodík, takže sa nevyskytujú minimálne kroky potrebné na oxidáciu.
Existujú spôsoby oxidácie ketónu (s okysličovadlami oveľa silnejšími ako tie, ktoré sa zvyčajne používajú), ale tieto molekuly rozbijú molekulu ketónu, pričom ju najprv rozdeľujú na dve alebo viac častí..
Priemyselný a každodenný život
V priemysle sa ketóny často pozorujú v parfumoch a farbách, pričom majú úlohu stabilizátorov a konzervačných látok, ktoré zabraňujú degradácii iných zložiek zmesi; majú tiež široké spektrum rozpúšťadiel v priemyselných odvetviach, ktoré okrem farmaceutických výrobkov vyrábajú výbušniny, farby a textílie.
Acetón (najmenší a najjednoduchší ketón) je celosvetovo uznávané rozpúšťadlo a používa sa ako odstraňovač farieb a riedidlo..
V prírode sa ketóny môžu javiť ako cukry, nazývané ketózy. Ketózy sú monosacharidy, ktoré obsahujú jeden ketón na molekulu. Najznámejšou ketosou je fruktóza, cukor nájdený v ovocí a medu.
Biosyntéza mastných kyselín, ku ktorej dochádza v cytoplazme živočíšnych buniek, sa tiež vyskytuje pôsobením ketónov. Nakoniec, ako je uvedené vyššie, môže nastať zvýšenie ketónov v krvi po hladovaní alebo v diabetických prípadoch.
Príklady ketónov
Butanón (C4H8O)
Tiež známa ako MEK (alebo MEC), táto kvapalina sa vyrába vo veľkom meradle v priemysle a používa sa ako rozpúšťadlo.
Cyklohexanón (C6H10O)
Tento ketón sa vyrába v masívnom meradle a používa sa ako prekurzor syntetického nylonového materiálu.
Testosterón (C19H22O2)
Je to hlavný hormón mužského pohlavia a anabolický steroid, ktorý sa nachádza vo väčšine stavovcov.
Progesterón (C21H30O2)
Endogénny steroid a pohlavný hormón zapojený do menštruačného cyklu, tehotenstva a embryogenézy u ľudí a iných druhov.
referencie
- Wikipedia. (N. D.). Ketón. Zdroj: en.wikipedia.org
- Britannica, E. (s.f.). Ketón. Získané z britannica.com
- University, M. S. (s.f.). Aldehydy a ketóny. Zdroj: chemistry.msu.edu
- ChemGuide. (N. D.). Zavádzanie aldehydov a ketónov. Zdroj: chemguide.co.uk
- Calgary, U. O. (s.f.). Ketóny. Zdroj: chem.ucalgary.ca


