Butínová štruktúra, vlastnosti a použitie
Butin je chemická zlúčenina, ktorá patrí do skupiny alkínov, vyznačujúca sa najmä tým, že má vo svojej štruktúre aspoň trojitú väzbu medzi dvoma atómami uhlíka..
Pokiaľ ide o stanovenie pravidiel pre označenie alkínov, IUPAC (akronym v anglickom jazyku pre Medzinárodnú úniu čistej a aplikovanej chémie) zistil, že sa používajú rovnako ako alkény..

Základným rozdielom medzi názvoslovím oboch typov látok je, že prípona -one sa mení na -or, pokiaľ ide o zlúčeniny, ktoré majú trojitú väzbu vo svojej štruktúre..
Na druhej strane, butín je zložený iba z uhlíka a vodíka a prichádza v dvoch formách: 1-butín, ktorý je v plynnej fáze pri štandardných podmienkach tlaku a teploty (1 atm, 25 ° C); a 2-butino, čo je druh kvapalnej fázy produkovaný chemickou syntézou.
index
- 1 Chemická štruktúra
- 1.1 1-butino
- 1,2 2-butín
- 2 Vlastnosti
- 3 Použitie
- 4 Odkazy
Chemická štruktúra
V molekule známej ako butino je prezentovaný fenomén štruktúrnej izomerizácie polohy, ktorý spočíva v prítomnosti rovnakých funkčných skupín v oboch zlúčeninách, ale každý z nich je na inom mieste reťazca..
V tomto prípade majú obe formy butínu rovnaký molekulový vzorec; avšak v 1-butíne je trojitá väzba lokalizovaná v uhlíkovom čísle jedna, zatiaľ čo v 2-butíne sa nachádza v druhej. To ich premieňa na polohové izoméry.
Vzhľadom na umiestnenie trojitej väzby v jednom z koncov štruktúry 1-butínovej štruktúry, je to považované za terminálny alkín, zatiaľ čo medziľahlá poloha trojitej väzby v štruktúre 2-butínu poskytuje klasifikáciu vnútorného alkínu..
Spojenie teda môže byť len medzi prvým a druhým uhlíkom (1-butín) alebo medzi druhým a tretím uhlíkom (2-butínom). Je to spôsobené aplikovanou nomenklatúrou, kde je vždy možné čo najmenej číslovať pozíciu trojitej väzby.
1-Butin
Zlúčenina nazývaná 1-butín je tiež známa ako etylacetylén, vzhľadom na svoju štruktúru a spôsob, akým sú usporiadané a viazané štyri atómy uhlíka. Avšak keď hovoríme Butin odkazuje len na tento chemický druh.
V tejto molekule sa trojitá väzba nachádza v terminálnom uhlíku, ktorý umožňuje dostupnosť atómov vodíka, ktoré mu dávajú veľkú reaktivitu.
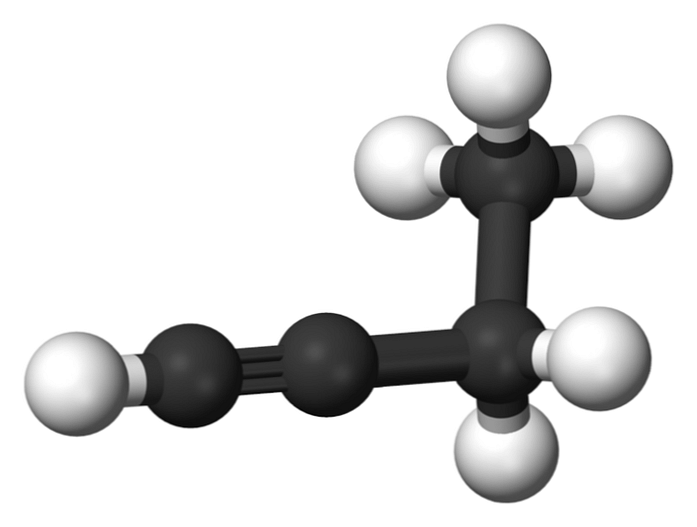
Táto tuhá a silnejšia väzba ako jednoduchá alebo dvojitá väzba medzi atómami uhlíka poskytuje stabilnú konfiguráciu 1-butínovej lineárnej geometrie.
Na druhej strane je táto plynná látka veľmi horľavá, takže v prítomnosti tepla môže ľahko spôsobiť požiar alebo výbuch a má veľkú reaktivitu v prítomnosti vzduchu alebo vody..
2-Butin
Pretože vnútorné alkyny vykazujú väčšiu stabilitu ako koncové alkíny, umožňujú transformáciu 1-butínu na 2-butín.
Táto izomerizácia sa môže uskutočniť zahrievaním 1-butínu v prítomnosti bázy (ako je NaOH, KOH, NaOCH3 ...) alebo prešmykom 1-butínu v roztoku hydroxidu draselného (KOH) v etanole (C2H6O).
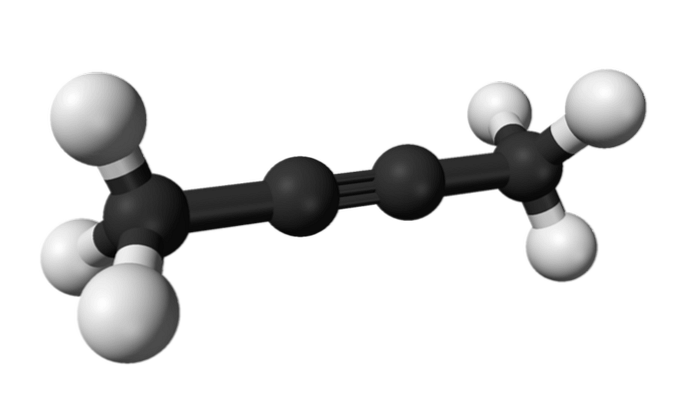
Rovnako je chemická látka známa ako 2-butín tiež nazývaná dimetylacetylén (alebo krotonylén), ktorý sa prezentuje ako kvapalný a prchavý druh, ktorý vzniká umelo..
V 2-butíne je trojitá väzba v strede molekuly, čo jej dáva väčšiu stabilitu ako jej izomér.
Okrem toho má táto bezfarebná zlúčenina nižšiu hustotu ako voda, hoci sa v nej považuje za nerozpustnú a má vysokú horľavosť..
vlastnosti
-Štruktúrny vzorec butínu (bez ohľadu na ktorý izomér je uvedený) je C4H6, ktorá má lineárnu štruktúru.
-Jednou z chemických reakcií, ktoré trpia butínovou molekulou, je izomerizácia, pri ktorej dochádza k preskupeniu a migrácii trojitej väzby v molekule..
-1-Butín je v plynnej fáze, má veľmi vysokú horľavosť a vyššiu hustotu ako vzduch.
-Táto látka je tiež veľmi reaktívna av prítomnosti tepla môže spôsobiť prudké výbuchy.
-Okrem toho, ak tento bezfarebný plyn vykazuje neúplnú reakciu spaľovania, môže spôsobiť oxid uhoľnatý (CO).
-Ak sú oba izoméry vystavené vysokým teplotám, môžu sa vyskytnúť polymerizačné reakcie s explozívnym typom.
-2-butín je v kvapalnej fáze, aj keď je tiež považovaný za veľmi horľavý pri štandardných tlakových a teplotných podmienkach.
-Tieto látky môžu pociťovať prudké reakcie, keď sú v prítomnosti silných oxidačných látok.
-Rovnakým spôsobom sa vyskytujú exotermické reakcie s následným uvoľňovaním plynného vodíka v prítomnosti redukujúcich druhov..
-Pri kontakte s určitými katalyzátormi (ako sú niektoré kyslé látky) alebo štartovacími druhmi sa môžu vyskytnúť exotermické polymerizačné reakcie..
aplikácie
Pretože majú niektoré odlišné vlastnosti, obidva izoméry môžu mať rôzne použitia a aplikácie, ako je uvedené nižšie:
V prvom rade je veľmi často jedným z použití 1-butínu jeho použitie ako medziprodukt v procese výroby iných látok organického charakteru syntetického pôvodu..
Na druhej strane sa tento chemický druh používa vo výrobnom priemysle gumy a odvodených zlúčenín; ako napríklad, keď chcete získať benzol.
Podobne sa používa vo výrobnom procese širokej škály plastových výrobkov, ako aj pri výrobe mnohých polyetylénových látok považovaných za vysokohustotné..
Tiež 1-butín sa často používa ako komponent na rezanie a zváranie niektorých kovových zliatin, vrátane ocele (zliatiny železa a uhlíka)..
V inom zmysle sa izomér 2-butínu používa v kombinácii s iným alkínom, ktorý sa nazýva propín, pri syntéze niektorých látok známych ako alkylované hydrochinóny, keď sa uskutočňuje proces totálnej syntézy a-tokoferolu (vitamín E)..
referencie
- Wikipedia. (N. D.). Butin. Zdroj: en.wikipedia.org
- Yoder, C.H., Leber P.A. a Thomsen, M.W. (2010). Most k organickej chémii: koncepty a nomenklatúra. Zdroj: books.google.co.ve
- Study.com. (N. D.). Butyn: Štruktúrny vzorec a izoméry. Získané zo štúdia.
- PubChem. (N. D.). 1-Butin. Zdroj: pubchem.ncbi.nlm.nih.gov
- PubChem. (N. D.). 2-Butin. Zdroj: pubchem.ncbi.nlm.nih.gov


