Bromid sodný (NaBr) Chemická štruktúra, vlastnosti a použitia
bromid sodný je chemický druh, ktorý patrí do solí anorganického pôvodu. Jeho štruktúra je zložená z brómhalogénu a kovového prvku sodíka v pomere 1: 1. Jeho chemický vzorec je NaBr a je v stave tuhej agregácie pri štandardných teplotných a tlakových podmienkach (25 ° C a 1 atm)..
Normálne sa môže pozorovať ako biely prášok a považuje sa za zlúčeninu kryštalického typu, ktorá tiež vykazuje hygroskopické správanie; to znamená, že má schopnosť absorbovať vlhkosť z okolia.

Podobne bromid sodný má fyzikálne vlastnosti veľmi podobné inej iónovej zlúčenine rovnakého kovu: chloridu sodného. Tento chlorid je reprezentovaný ako NaCl, ktorý je bežnejšie známy ako bežná soľ alebo stolová soľ.
Má veľký počet použití v rôznych oblastiach vedy; používa sa napríklad pri výrobe rôznych druhov liekov (sedatív, hypnotík, antikonvulzív, okrem iných), ako aj pri organickej syntéze a dokonca aj pri fotografických aplikáciách.
index
- 1 Chemická štruktúra
- 1.1 Chemická syntéza
- 2 Vlastnosti
- 3 Použitie
- 4 Odkazy
Chemická štruktúra
Ako bolo uvedené vyššie, bromid sodný sa vyskytuje v pevnej fáze a, podobne ako mnohé iné soli anorganickej povahy, má kryštalickú štruktúrnu konformáciu.
Táto kryštalická molekula, pozostávajúca z atómu brómu a atómu vodíka, má konformáciu kubického typu v strede tváre, ako sú haloidné soli rovnakého kovu (NaI, NaF a NaCl)..
Toto molekulárne usporiadanie tvorí štruktúrny základ mnohých zlúčenín, v ktorých sa usporiadanie uskutočňuje tak, že každý ión je udržiavaný v strede oktaedrálneho obrázku, ako je znázornené na nasledujúcom obrázku..
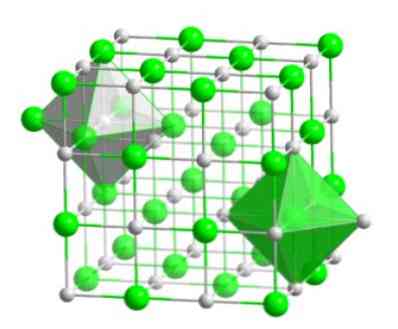
V tomto type kryštálu môžete vidieť, ako každý z iónov má okolo neho šesť ďalších iónov, ktoré majú opačný elektrický náboj, ktoré sa nachádzajú na koncoch oktaedrálneho obrázku..
Štruktúra tejto iónovej látky tiež znamená, že má vysokú teplotu topenia približne 747 ° C, ktorá je komerčne vo svojich dvoch formách: bezvodý druh (bez molekúl vody) a dihydrátovaný druh (s dvoma molekulami vody v jej molekule). Štruktúrny vzorec (NaBr-2H2O)), ktorých teploty topenia sú rozdielne.
Chemická syntéza
Bromid sodný je spôsobený chemickou reakciou, ku ktorej dochádza medzi bromovodíkom (BrH, halogenovodík v plynnej fáze) a hydroxidom sodným (NaOH, silná báza v tuhej fáze as hygroskopickými vlastnosťami)..
Týmto spôsobom sa vyrába komerčne pridaním nadbytku brómu do roztoku NaOH. Toto tvorí zmes bromid / bróm. Následne sa výsledné produkty podrobia odpareniu až do vysušenia a spracujú sa uhlíkom, aby sa vytvorila redukčná reakcia bromičnanového iónu (BrO).3-) na bromidový ión (Br-).
protiakcie
Podobne môže byť táto anorganická soľ tiež pripravená neutralizačnou reakciou uhličitanu sodného (Na2CO3) s kyselinou brómovou (HBrO)3), podľa rovnakého postupu opísaného vyššie.
Syntéza môže byť vyrobená reakciou železa s brómom a vodou. Ako produkt tejto reakcie vzniká železo-železitý bromid.
Následne sa tento druh tvoril (reprezentovaný ako FeBr2/ FeBr3sa rozpustí vo vode a pridá sa určité množstvo uhličitanu sodného. Nakoniec sa roztok prefiltruje a nechá prejsť odparovaním, aby sa konečne získal bromid sodný.
vlastnosti
- Bežne sa nachádza v stave pevnej agregácie vo forme bieleho prášku.
- Má kryštalickú štruktúru, s molekulárnym usporiadaním v tvare kocky v strede tváre.
- Teplota topenia tejto látky je približne 747 ° C pre jej bezvodú formu a 36 ° C pre jej dihydratovanú formu, čo ukazuje rozklad pred roztavením..
- Skladá sa zo sodíkových iónov (Na+a bromidový ión (Br-), s molárnou hmotnosťou alebo molekulovou hmotnosťou 102,89 g / mol.
- Jeho bod varu je dosť vysoký, pozorovaný pri 1390 ° C (ekvivalent 2530 ° F alebo 1660 K).
- Rozpustnosť tohto druhu je okolo 94,32 g / 100 ml vo vode pri 25 ° C, so zvyšujúcou sa teplotou.
- Keď sa táto látka podrobí ohrevu až do bodu, keď sa rozkladá, uvoľňuje plyny z brómu a oxidu sodného považované za toxické.
- Hustota bezvodej formy bromidu sodného je 3,21 g / cm3, zatiaľ čo dihydrátová zlúčenina je 2,18 g / cm3.
- Jeho rozpustnosť v alkohole sa považuje za miernu, ako v iných rozpúšťadlách, ako je pyridín, amoniak a hydrazín.
- Má nerozpustnosť voči acetonitrilu a acetónu.
aplikácie
- V oblasti medicíny sa používa ako liečivo na veľké množstvo stavov, ktoré spôsobujú záchvaty a ako terapia na prevenciu epilepsie u pacientov s Wolf-Hirschhornovým syndrómom, ako aj pri sedatívnych a hypnotických liekoch..
- Vo veterinárnej medicíne sa používajú psi, ktorí majú záchvatové poruchy kvôli vedľajším účinkom liekov, ako sú fenobarbital alebo primidón.
- V oblasti ropného priemyslu sa používa v procesoch prípravy určitých kvapalín rôznej hustoty, ktoré sa používajú v ropných vrtoch.
- V oblasti biologického výskumu boli preukázané jeho mikrobiocídne vlastnosti; to znamená, že sa používa na kontrolu vývoja rôznych druhov baktérií.
- Pri určitých syntézach organického typu sa táto anorganická soľ používa na prípravu iných druhov tvorených brómom. Napríklad pomocou reakcie Finkelsteinu sa získajú niektoré alkylhalogenidy s vyššou reaktivitou, z ktorých jedna sa používala na fotografovanie..
- V oblasti čistenia a dezinfekcie sa bromid sodný používa v kombinácii s chlórom na sanáciu veľkých objemov vody, ako sú bazény a vírivky..
referencie
- Wikipedia. (N. D.). Bromid sodný. Zdroj: en.wikipedia.org
- PubChem. (N. D.). Bromid sodný. Zdroj: pubchem.ncbi.nlm.nih.gov
- Johnson, A. W. (1999). Pozvánka na organickú chémiu. Zdroj: books.google.co.ve
- Science Direct. (N. D.). Bromid sodný. Zdroj: sciencedirect.com
- Riviere, J. E. a Papich, M. G. (2009). Veterinárna farmakológia a terapeutiká. Zdroj: books.google.co.ve


