Štruktúra oxidov striebra (Ag2O), vlastnosti, názvoslovie a použitie
oxid strieborný "Anorganická zlúčenina" je anorganická zlúčenina, ktorej chemický vzorec je Ag2O. Sila, ktorá spája jej atómy, má úplne iónovú povahu; preto pozostáva z iónovej pevnej látky, kde je pomer dvoch katiónov Ag+ interaguje elektrostaticky s aniónom O2-.
Oxidový anión, O2-, je výsledkom interakcie atómov striebra povrchu s kyslíkom prostredia; podobným spôsobom ako železo a mnoho ďalších kovov. Strieborný kus alebo šperky namiesto sčervenania a rozpadania sa na hrdzu sa zmenia na čiernu, charakteristickú pre oxid strieborný.

Napríklad na obrázku hore môžete vidieť hrdzavý strieborný pohár. Všimnite si jeho čierny povrch, aj keď si stále zachováva nejaký okrasný lesk; čo je dôvod, prečo aj hrdzavé strieborné predmety možno považovať za dostatočne atraktívne pre dekoratívne účely.
Vlastnosti oxidu strieborného sú také, že na prvý pohľad nepokazia pôvodný kovový povrch. Vytvára sa pri izbovej teplote jednoduchým kontaktom s kyslíkom vo vzduchu; a ešte zaujímavejšie, môže sa rozkladať pri vysokých teplotách (nad 200 ° C).
To znamená, že ak by sa sklo obrazu uchovalo a teplo intenzívneho plameňa by sa aplikovalo, obnovilo by to svoj strieborný lesk. Preto je jeho tvorba termodynamicky reverzibilným procesom.
Oxid strieborný má aj iné vlastnosti a okrem svojho jednoduchého zloženia Ag2Alebo zahŕňa komplexné štrukturálne organizácie a bohatú škálu pevných látok. Ag2Alebo je to snáď vedľa Ag2O3, najreprezentatívnejšie oxidy striebra.
index
- 1 Štruktúra oxidu strieborného
- 1.1 Zmeny v počte valencia
- 2 Fyzikálne a chemické vlastnosti
- 2.1 Molekulová hmotnosť
- 2.2 Vzhľad
- 2.3 Hustota
- 2.4 Teplota topenia
- 2,5 Kps
- 2.6 Rozpustnosť
- 2.7 Kovalentný charakter
- 2.8 Rozklad
- 3 Nomenklatúra
- 3.1 Valencia I a III
- 3.2 Systematická nomenklatúra komplexných oxidov striebra
- 4 Použitie
- 5 Referencie
Štruktúra oxidu strieborného
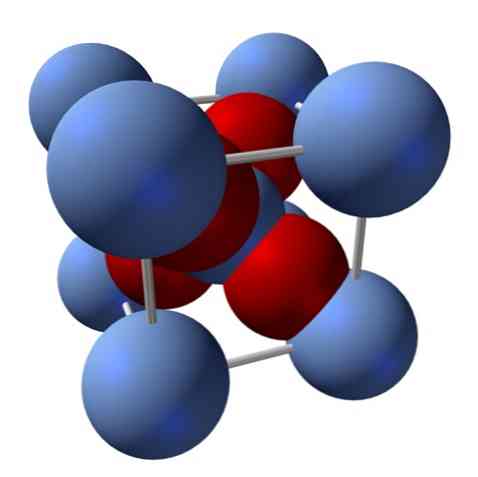
Aká je jeho štruktúra? Ako bolo uvedené na začiatku: je to iónová pevná látka. Z tohto dôvodu nemôžu byť vo svojej štruktúre kovalentné väzby Ag-O ani Ag = O; pretože, ak by existovali, vlastnosti tohto oxidu by sa drasticky zmenili. Potom sú to ióny Ag+ a O2- v pomere 2: 1 a zažíva elektrostatickú príťažlivosť.
Štruktúra oxidu strieborného je v dôsledku toho determinovaná spôsobom, ktorým iónové sily pôsobia v priestore iónov Ag+ a O2-.
Napríklad v hornom obrázku máte jednotkovú bunku pre kubický kryštalický systém: katióny Ag+ sú strieborné modré gule a O2- načervenalé oblasti.
Ak spočítate počet guľôčok, zistíte, že na prvý pohľad existuje deväť striebristo modrých a štyroch červených farieb. Zohľadňujú sa však len fragmenty guľôčok obsiahnutých v kocke; Pri výpočte týchto hodnôt, ktoré sú zlomkami celkových sfér, sa musí splniť pomer 2: 1 pre Ag2O.
Opakovanie konštrukčnej jednotky tetraedrónu AgO4 obklopené štyrmi ďalšími Ag+, všetka čierna pevná látka je postavená (odstraňuje medzery alebo nezrovnalosti, ktoré tieto kryštálové usporiadania môžu mať).
Zmeny s počtom valencia
Zamerať sa teraz nie na tetraedr AgO4 ale v línii AgOAg (pozorovať vrcholy hornej kocky) bude to, že tuhá látka z oxidu strieborného pozostáva z inej perspektívy viac iónových vrstiev usporiadaných lineárne (aj keď šikmo). To všetko ako výsledok "molekulárnej" geometrie okolo Ag+.
Vyššie uvedené bolo potvrdené niekoľkými štúdiami iónovej štruktúry.
Striebro pracuje prevažne s valenciou +1, pretože pri strate elektrónu je výsledná elektronická konfigurácia [Kr] 4d10, ktorý je veľmi stabilný. Iné valencie, ako napríklad Ag2+ a Ag3+ sú menej stabilné, pretože strácajú elektróny z orbitálov takmer úplne naplnené.
Agón3+, v porovnaní s Ag je však relatívne menej nestabilný2+. V skutočnosti môže existovať v spoločnosti Ag+ Chemické obohatenie štruktúry.
Jeho elektronická konfigurácia je [Kr] 4d8, s nepárovými elektrónmi takým spôsobom, ktorý jej dáva určitú stabilitu.
Na rozdiel od lineárnej geometrie okolo iónov Ag+, Zistilo sa, že ióny Ag3+ Je štvorcový. Preto oxid strieborný s iónmi Ag3+ by pozostával z vrstiev zložených z štvorcov AgO4 (nie tetraedra) elektrostaticky viazané AgOAg líniami; Taký je prípad Ag4O4 alebo Ag2O ∙ Ag2O3 s monoklinickou štruktúrou.
Fyzikálne a chemické vlastnosti

Ak poškriabate povrch strieborného pohára hlavného obrazu, dostanete pevnú látku, ktorá je nielen čierna, ale má tiež hnedé alebo hnedé tóny (vrchný obrázok). Niektoré z jeho fyzikálnych a chemických vlastností, ktoré udávajú momenty, sú nasledovné:
Molekulová hmotnosť
231,735 g / mol
vzhľad
Tuhá čiernohnedá v práškovej forme (všimnite si, že napriek tomu, že je iónová pevná látka, nemá kryštalický vzhľad). Je bez zápachu a zmiešaný s vodou mu dáva kovovú chuť
hustota
7,14 g / ml.
Teplota topenia
277 až 300 ° C. Určite sa topí v pevnom striebre; to znamená, že sa pravdepodobne rozpadne pred tvorbou kvapalného oxidu.
KPS
1,52 ∙ 10-8 vo vode pri 20 ° C. Je to teda zlúčenina, ktorá je sotva rozpustná vo vode.
rozpustnosť
Ak sa pozriete pozorne na obraz jeho štruktúry, zistíte, že gule Ag2+ a O2- Nesúhlasia takmer vo veľkosti. Výsledkom je, že len malé molekuly môžu preniknúť dovnútra kryštalickej mriežky, čo ju robí nerozpustnou v takmer všetkých rozpúšťadlách; okrem tých, kde reaguje, ako sú zásady a kyseliny.
Kovalentný charakter
Hoci sa opakovane hovorilo, že oxid strieborný je iónová zlúčenina, určité vlastnosti, ako napríklad jeho nízka teplota topenia, sú v rozpore s týmto tvrdením..
Samozrejme, uvažovanie o kovalentnom charaktere nerozbije to, čo je vysvetlené pre jeho štruktúru, stačilo by ho pridať do štruktúry Ag2Alebo model sfér a tyčiniek na označenie kovalentných väzieb.
Tiež, tetrahedra a štvorcových lietadiel AgO4, ako aj línie AgOAg by boli spojené kovalentnými (alebo kovalentnými iónovými) väzbami.
S týmto vedomím Ag2Alebo by to skutočne bol polymér. Odporúča sa však považovať ju za iónovú pevnú látku s kovalentným charakterom (ktorej povaha je v súčasnosti stále výzvou).
rozklad
Spočiatku bolo spomenuté, že jeho tvorba je termodynamicky reverzibilná, takže absorbuje teplo, aby sa vrátila do svojho kovového stavu. Toto všetko môže byť vyjadrené dvoma chemickými rovnicami pre takéto reakcie:
4Ag (s) + O2(g) => 2Ag2O (s) + Q
2AG2O (s) + Q => 4Ag (s) + O2(G)
Kde Q predstavuje teplo v rovnici. To vysvetľuje, prečo oheň horiaci povrch zhrdzaveného strieborného pohára vracia svoj strieborný lesk.
Preto je ťažké predpokladať, že existuje Ag2O (l), pretože by sa okamžite rozložilo teplom; pokiaľ nie je tlak príliš vysoký na získanie uvedenej hnedej čiernej kvapaliny.
názvoslovie
Keď bola zavedená možnosť iónov Ag2+ a Ag3+ okrem bežného a prevládajúceho Ag+, termín „oxid strieborný“ sa začína javiť ako nedostatočný na označenie Ag2O.
Je to preto, lebo Ag ión+ je bohatší ako ostatní, takže Ag je braný2Alebo ako jediný oxid; nie je správne.
Ak uvažujete o Ag2+ ako prakticky neexistujúca vzhľadom na jeho nestabilitu, potom budú prítomné len ióny s valenciami +1 a +3; to znamená Ag (I) a Ag (III).
Valencie I a III
Byť Ag (I) najmenšou valenciou, je pomenovaný pridaním prípony -oso k svojmu názvu Argentum. Tak, Ag2Alebo je to: argentosoxid alebo, podľa systematickej nomenklatúry, diplata monoxid.
Ak je Ag (III) úplne ignorovaný, potom musí byť tradičnou nomenklatúrou: oxid strieborný namiesto oxidu strieborného.
Na druhej strane, Ag (III), ktorý je väčšou valenciou, pridáva príponu -ico k svojmu názvu. Tak, Ag2O3 je: oxid strieborný (2 Ag ióny)3+ s tromi O2-). Jeho názov podľa systematickej nomenklatúry by bol tiež: diplata trioxide.
Ak je pozorovaná štruktúra Ag2O3, možno predpokladať, že je produktom oxidácie ozónom, OR3, namiesto kyslíka. Preto jej kovalentný charakter musí byť väčší, pretože ide o kovalentnú zlúčeninu s väzbami Ag-O-O-O-Ag alebo Ag-O.3-ag.
Systematická nomenklatúra pre komplexné oxidy striebra
AgO, tiež napísané ako Ag4O4 alebo Ag2O ∙ Ag2O3, je to oxid strieborný (I, III), pretože má obidve valencie +1 a +3. Jeho názov podľa systematickej nomenklatúry by bol: tetraoxid tetraoxid.
Táto nomenklatúra má veľký význam, pokiaľ ide o iné stechiometricky zložitejšie oxidy striebra. Predpokladajme napríklad dve pevné látky 2Ag2O ∙ Ag2O3 a Ag2O ∙ 3Ag2O3.
Vhodnejšie by písanie prvého bolo: Ag6O5 (počítanie a pridávanie atómov Ag a O). Jeho meno by potom bolo hexaplate pentoxide. Všimnite si, že tento oxid má zloženie striebra menej bohaté ako Ag2O (6: 5) < 2:1).
Pri písaní druhej pevnej hodnoty by to bolo: Ag8O10. Jeho názov by bol oktaplát deoxid (s pomerom 8:10 alebo 4: 5). Tento hypotetický oxid strieborný by bol "veľmi oxidovaný".
aplikácie
Štúdie zamerané na nové a sofistikované spôsoby použitia oxidu strieborného sa v súčasnosti stále vykonávajú. Niektoré z jeho použití sú uvedené nižšie:
-Rozpúšťa sa v amoniaku, dusičnane amónnom a vo vode za vzniku Tollenovho činidla. Toto činidlo je užitočným nástrojom pri kvalitatívnych analýzach v laboratóriách organickej chémie. Umožňuje určiť prítomnosť aldehydov vo vzorke, pričom pozitívnou odozvou je vytvorenie "strieborného zrkadla" v skúmavke..
-Spolu s kovovým zinkom tvorí primárne batérie oxidu zinočnatého striebra. To je snáď jeden z jeho najčastejších a domáce použitie.
-Slúži ako čistička plynu, absorbujúca napríklad CO2. Pri zahriatí uvoľňuje zachytené plyny a môže byť niekoľkokrát opätovne použitý.
-Vzhľadom k antimikrobiálnym vlastnostiam striebra je jeho oxid užitočný pri štúdiách bioanalýzy a čistenia pôdy.
-Je to mierne oxidačné činidlo schopné oxidovať aldehydy na karboxylové kyseliny. Používa sa tiež pri Hofmannovej reakcii (terciárne amíny) a podieľa sa na iných organických reakciách, buď ako činidlo alebo katalyzátor.
referencie
- Bergstresser M. (2018). Oxid strieborný: Vzorec, rozklad a formácia. Štúdia. Zdroj: study.com
- Autori a redaktori zväzkov III / 17E-17F-41C. (N. D.). Oxidy striebra (kryštalická štruktúra Ag (x) O (y)), parametre mriežky. (Numerické údaje a funkčné vzťahy vo vede a technológii), zv. 41C. Springer, Berlín, Heidelberg.
- Mahendra Kumar Trivedi, Rama Mohan Tallapragada, Alice Branton, Dahryn Trivedi, Gopal Nayak, Omprakash Latiyal, Snehasis Jana. (2015). Možný vplyv energetického spracovania biopoly na fyzikálne a tepelné vlastnosti práškového oxidu strieborného. Medzinárodný vestník biomedicínskej vedy a inžinierstva. 3, č. 5, str. 62-68. doi: 10.11648 / j.ijbse.20150305.11
- Sullivan R. (2012). Rozklad oxidu strieborného. Univerzita v Oregone Zdroj: chemdemos.uoregon.edu
- Flint, Deyanda. (24. apríl 2014). Použitie batérií s oxidom strieborným. Sciencing. Zdroj: sciencing.com
- Salman Montasir E. (2016). Štúdium niektorých optických vlastností oxidu strieborného (Ag2o) pomocou UVVisible spektrofotometra. [PDF]. Zdroj: iosrjournals.org
- Bard Allen J. (1985). Štandardné potenciály vo vodnom roztoku. Marcel Dekker. Zdroj: books.google.co.ve


