Atómový objem Ako sa líši v periodickej tabuľke a príkladoch
atómový objem je relatívna hodnota, ktorá označuje vzťah medzi molárnou hmotnosťou prvku a jeho hustotou. Tento objem teda závisí od hustoty prvku a hustota závisí od fázy a od toho, ako sú atómy usporiadané v tejto oblasti..
Takže atómový objem Z prvku nie je rovnaký v inej fáze, ako je tá, ktorá sa prejavuje pri teplote miestnosti (kvapalina, tuhá látka alebo plyn), alebo keď je súčasťou určitých zlúčenín. Atómový objem Z v zlúčenine ZA je teda odlišný od Z v zlúčenine ZB.

Prečo? Na pochopenie je potrebné porovnať atómy napríklad s guľôčkami. Guľôčky, podobne ako modrasté mramory vynikajúceho obrazu, majú veľmi dobre definovanú materiálovú hranicu, ktorá je pozorovaná vďaka brilantnému povrchu. Na rozdiel od toho je hranica atómov difúzna, hoci môžu byť považované za vzdialene sférické.
Takže, čo určuje bod za atómovou hranicou, je nulová pravdepodobnosť nájdenia elektrónu a tento bod môže byť ďalej alebo bližšie k jadru v závislosti od toho, koľko susediacich atómov vzájomne ovplyvňuje uvažovaný atóm..
index
- 1 Atómový objem a polomer
- 2 Doplňujúci vzorec
- 3 Ako sa mení atómový objem v periodickej tabuľke?
- 3.1 Atómové objemy prechodných kovov
- 4 Príklady
- 4.1 Príklad 1
- 4.2 Príklad 2
- 5 Referencie
Atómový objem a polomer
Interakciou dvoch atómov H v molekule H2, sú definované polohy ich jadier, ako aj vzdialenosti medzi nimi (medzirekrétne vzdialenosti). Ak sú oba atómy sférické, polomer je vzdialenosť medzi jadrom a difúznou hranicou:
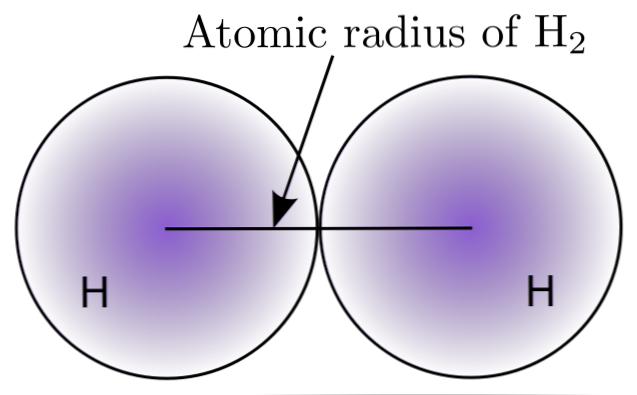
V hornom obrázku je vidieť, ako sa pravdepodobnosť nájdenia elektrónu znižuje, keď sa pohybuje od jadra. Rozdelením internukleárnej vzdialenosti medzi dvoma sa získa atómový polomer. Ďalej, za predpokladu sférickej geometrie pre atómy, používame vzorec na výpočet objemu gule:
V = (4/3) (Pi) r3
V tomto výraze r je atómový polomer určený pre molekulu H2. Hodnota V vypočítaná touto nepresnou metódou sa môže zmeniť, ak sa napríklad uvažuje o H2 v kvapalnom alebo kovovom stave. Táto metóda je však veľmi nepresná, pretože tvary atómov sú vo svojej interakcii ďaleko od ideálnej sféry.
Na stanovenie atómových objemov v tuhých látkach sa berie do úvahy mnoho premenných týkajúcich sa usporiadania, ktoré sa získajú rôntgenovými difrakčnými štúdiami..
Dodatočný vzorec
Molárna hmotnosť vyjadruje množstvo hmoty, ktorá má jeden mol atómov chemického prvku.
Jeho jednotky sú g / mol. Na druhej strane, hustota je objem, ktorý zaberá jeden gram prvku: g / ml. Pretože jednotky atómového objemu sú ml / mol, musíte hrať s premennými, aby ste dosiahli požadované jednotky:
(g / mol) (ml / g) = ml / mol
Alebo čo je rovnaké:
(Molová hmotnosť) (1 / D) = V
(Molová hmotnosť / D) = V
Tak sa dá ľahko vypočítať objem jedného mólu atómov prvku; zatiaľ čo so vzorcom sférického objemu sa vypočíta objem jednotlivého atómu. Na dosiahnutie tejto hodnoty od prvej je potrebná konverzia prostredníctvom čísla Avogadro (6,02 · 10).-23).
Ako sa mení atómový objem v periodickej tabuľke?
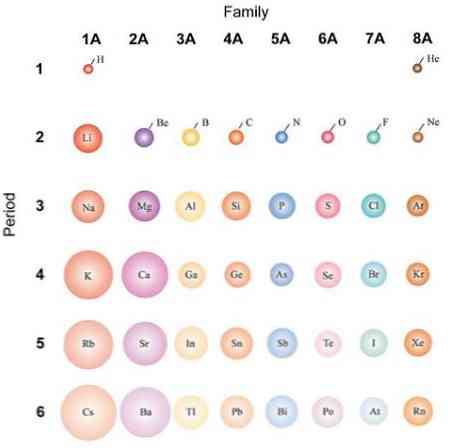
Ak sú atómy považované za sférické, potom ich variácia bude rovnaká ako v atómových polomeroch. V hornom obrázku, ktorý znázorňuje reprezentatívne prvky, je znázornené, že sprava doľava atómy trpaslíka; namiesto toho sa zhora nadol stávajú objemnejšími.
Je to preto, že v rovnakom období jadro obsahuje protóny, keď sa pohybuje doprava. Tieto protóny pôsobia atraktívnou silou na vonkajšie elektróny, ktoré pociťujú účinný jadrový náboj Zeff, menej ako skutočný jadrový náboj Z.
Elektrony vnútorných vrstiev odpudzujú elektróny vonkajšej vrstvy, čím znižujú účinok jadra na tieto vrstvy; Toto je známe ako efekt obrazovky. V tom istom období efekt obrazovky nereaguje proti zvýšeniu počtu protónov, takže elektróny vo vnútornej vrstve nezabraňujú kontrakcii atómov..
Avšak zostupom do skupiny sú povolené nové energetické hladiny, ktoré umožňujú elektrónom obiehať ďalej od jadra. Tiež sa zvyšuje počet elektrónov vo vnútornej vrstve, ktorých tieniace účinky sa začínajú zmenšovať, ak jadro opäť pridá protóny.
Z týchto dôvodov je možné vidieť, že skupina 1A má najviac objemné atómy, na rozdiel od malých atómov skupiny 8A (alebo 18), atómov vzácnych plynov.
Atómové objemy prechodných kovov
Atómy prechodných kovov obsahujú elektróny k vnútorným orbitálom d. Toto zvýšenie efektu obrazovky, ako aj skutočného jadrového náboja Z sa takmer rovnako ruší, takže ich atómy si v rovnakom období zachovávajú svoju podobnú veľkosť..
Inými slovami: v jednom období vykazujú prechodné kovy podobné atómové objemy. Tieto malé rozdiely sú však nesmierne dôležité pri definovaní kovových kryštálov (ako keby to boli kovové guličky).
Príklady
Na výpočet atómového objemu prvku sú k dispozícii dva matematické vzorce, každý so zodpovedajúcimi príkladmi.
Príklad 1
Vzhľadom na atómový polomer vodíka -37 pm (1 picometer = 10)-12m) - a cézia -265 pm-, vypočítajú jeho atómové objemy.
Pomocou vzorca guľového objemu potom máme:
VH= (4/3) (3,14) (37 hod.)3= 212,07 pm3
Vsk= (4/3) (3,14) (265 hodín)3= 77912297,67 pm3
Avšak tieto objemy vyjadrené v pyrometroch sú exorbitantné, takže sú transformované do jednotiek angstromov, ktoré sú násobené konverzným faktorom (1 Á / 100pm).3:
(212,07 hod.)3) (1 Á / 100pm)3= 2,1207 × 10-4 Å3
(77912297,67 pm.)3) (1 Á / 100pm)3= 77,912 Á3
Rozdiely vo veľkosti medzi malým atómom H a objemným atómom Cs teda zostávajú numericky evidentné. Treba mať na pamäti, že tieto výpočty sú iba aproximáciami pod tvrdením, že atóm je úplne sférický, ktorý putuje tvárou v tvár realite.
Príklad 2

Hustota čistého zlata je 19,32 g / ml a jeho molekulová hmotnosť je 196,97 g / mol. Použitie vzorca M / D na výpočet objemu jedného mólu zlatých atómov má nasledujúce:
Vau= (196,97 g / mol) / (19,32 g / ml) = 10,19 ml / mol
To znamená, že 1 mól atómov zlata zaberá 10,19 ml, ale aký objem má atóm zlata špecificky? A ako ho vyjadriť v jednotkách pm3? Jednoducho jednoducho aplikujte nasledujúce faktory konverzie:
(10,19 ml / mol) (mol / 6,02 · 10)-23 atómy) (1 m / 100 cm)3· (1 pm / 10-12m)3= 16,92 · 106 popoludní3
Na druhej strane, atómový polomer zlata je 166 pm. Ak porovnáte oba zväzky - ten, ktorý bol získaný predchádzajúcou metódou a ten, ktorý bol vypočítaný pomocou vzorca sférického objemu - zistíte, že nemajú rovnakú hodnotu:
Vau= (4/3) (3,14) (166 hodín)3= 19,15 · 106 popoludní3
Ktorý z nich je najbližšie k akceptovanej hodnote? Ten, ktorý je najbližšie k experimentálnym výsledkom získaným rôntgenovou difrakciou kryštalickej štruktúry zlata.
referencie
- Helmenstine, Anne Marie, Ph.D. (9. decembra 2017). Definícia atómového objemu. Získané dňa 6. júna 2018, z: thoughtco.com
- Mayfair, Andrew. (13. marec 2018). Ako vypočítať objem Atómu. sciencing. Získané dňa 6. júna 2018, z: sciencing.com
- Wiki Kids Ltd. (2018). Lothar Meyer Atómový objem krivky. Získané dňa 6. júna 2018, z: wonderwhizkids.com
- Lumen. Periodické trendy: Atómový rádius. Získané dňa 6. júna 2018, z: courses.lumenlearning.com
- Camilo J. Derpich. Objem a atómová hustota. Získané dňa 6. júna 2018, z: es-puraquimica.weebly.com
- Whitten, Davis, Peck & Stanley. Chémia. (8. vydanie). CENGAGE Learning, str. 222-224.
- Nadácia CK-12. (22. februára 2010). Porovnateľné atómové veľkosti. [Obrázok]. Získané dňa 6. júna 2018, z: commons.wikimedia.org
- Nadácia CK-12. (22. február 2010). Atómový polomer H2. [Obrázok]. Získané dňa 6. júna 2018, z: commons.wikimedia.org


