Vzorec hydridu horečnatého, chemická štruktúra a vlastnosti
hydridom horečnatým (MGH2 molekulárneho vzorca), je chemická zlúčenina s obsahom vodíka 7,66% a nachádza sa v prírode ako biela kryštalická tuhá látka. Používa sa hlavne na prípravu iných chemických látok, aj keď sa tiež skúmalo ako potenciálne skladovacie médium pre vodík.
Patrí do skupiny fyziologických (alebo iónových) hydridov, ktoré sú definované H-iónmi negatívne nabitými. Tieto hydridy sú považované za tie, ktoré sú vytvorené z alkalických kovov a kovov alkalických zemín, ale v prípade horčíka (a berýlia) majú kovalentné väzby, okrem tých, ktoré charakterizujú túto skupinu hydridov..
index
- 1 Príprava a vzorec
- 2 Chemická štruktúra
- 3 Fyzikálne a chemické vlastnosti
- 3.1 Fyzické
- 3.2 Chemikálie
- 4 Použitie
- 4.1 Skladovanie vodíka
- 4.2 Reakcie hydrogenácie a dehydrogenácie
- 4.3
- 4.4 Palivové články
- 4.5 Doprava a energetika
- 4.6 Alkylácia
- 5 Riziká
- 5.1 Reakcia s vodou
- 5.2 Je pyroforický
- 6 Referencie
Príprava a vzorec
Hydrid horečnatý sa tvorí priamou hydrogenáciou horčíka (Mg) za podmienok vysokého tlaku a teploty (200 atmosfér, 500 ° C) s MgI katalyzátorom.2. Jeho reakcia je ekvivalentná:
Mg + H2→ MgH2
Tiež sa skúmala produkcia MgH2 pri nižších teplotách s použitím nanokryštalického horčíka vyrobeného v guľových mlynoch.
Existujú aj iné spôsoby prípravy, ale predstavujú zložitejšie chemické reakcie (hydrogenácia horčíka a antracénu, reakcia medzi dietylmagnéziom s hydridom lítno-hlinitým a ako produkt komplexu MgH).2).
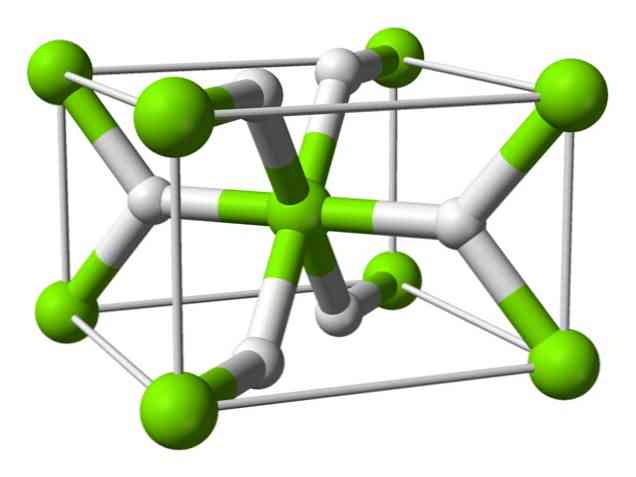
Chemická štruktúra
Tento atóm má pri izbovej teplote štruktúru rutilu s tetragonálnou kryštalickou štruktúrou. Má najmenej štyri rôzne formy za podmienok vysokého tlaku a tiež bola pozorovaná nestechiometrická štruktúra s nedostatkami vodíka; posledne uvedené sa vyskytuje len vo veľmi malých množstvách častíc, keď sa tvoria.
Ako je uvedené vyššie, väzby, ktoré existujú v rutilovej štruktúre, majú čiastočne kovalentné vlastnosti namiesto toho, aby boli čisto iónové, ako iné fyziologické hydridy..
To spôsobuje, že atóm horčíka má sférický tvar, úplne ionizovaný, ale jeho hydridový ión má predĺženú štruktúru.
Fyzikálne a chemické vlastnosti
fyzický
- Vzhľad: Biele kryštály.
- Molárna hmotnosť: 26,3209 g / mol
- Hustota: 1,45 g / cm3
- Teplota topenia: 285 ° C sa rozkladá
- Rozpustnosť: Vo vode sa rozkladá.
Táto chemická zlúčenina má molekulovú hmotnosť 26 321 g / mol, hustotu 1,45 g / cm3 a teplotu topenia 327 ° C..
chemický
- Prekurzor na výrobu iných chemických látok.
- Skladovanie vodíka ako možný zdroj energie.
- Redukčné činidlo v organickej syntéze.
Je dôležité uviesť, že táto zlúčenina nemôže byť privedená do kvapalného stavu a keď je nesená alebo jej bod topenia alebo zavedená do vody, rozkladá sa. Tento hydrid je nerozpustný v éteri.
Je to vysoko reaktívna a vysoko horľavá látka a je tiež pyroforická, to znamená, že sa môže samovoľne vznietiť vo vzduchu. Tieto tri podmienky predstavujú bezpečnostné riziká, ktoré budú uvedené v poslednej časti tohto článku.
aplikácie
Skladovanie vodíka
Hydrid horečnatý ľahko reaguje s vodou za vzniku plynného vodíka prostredníctvom nasledujúcej chemickej reakcie:
MGH2+2H2O → 2H2+Mg (OH)2
Okrem toho sa táto látka rozkladá pri teplote 287 ° C a tlaku 1 bar takto:
MGH2→ Mg + H2
Preto sa navrhuje použitie hydridu horečnatého ako média na skladovanie vodíka na jeho použitie a dopravu.
Hydrogenácia a dehydrogenácia množstva kovového horčíka sa navrhuje ako spôsob transportu množstva plynného vodíka, čím sa zabezpečí, že nedochádza k úniku v jeho preprave a že predstavuje bezpečnejší a praktickejší spôsob ako pri použití vysokotlakových nádob..
Hydrogenačné a dehydrogenačné reakcie
Hoci teplota rozkladu hydridu horečnatého predstavuje limitujúci faktor pre jeho použitie, boli navrhnuté spôsoby na zlepšenie kinetiky hydrogenačných a dehydrogenačných reakcií. Jedným z nich je redukcia veľkosti častíc horčíka s použitím guľových mlynov.
bahno
Okrem toho bol navrhnutý systém, ktorý produkuje hydrid horečnatý vo forme bahna (lepšie zvládnuteľný a bezpečnejší ako v prášku alebo iných tuhých časticiach), ktorý by reagoval s vodou na získanie požadovaného vodíka..
Odhaduje sa, že skôr uvedený kal by bol tvorený jemne mletým hydridom, chráneným ochrannou vrstvou olejov a suspendovaný v dispergačných činidlách, aby sa zabezpečilo, že si zachováva svoju konzistenciu bez straty materiálu a že neabsorbuje vlhkosť z okolitého prostredia..
Tento kal má tú výhodu, že sa môže čerpať cez akúkoľvek bežnú naftu, benzín alebo vodné čerpadlo, čím sa tento ekonomický návrh, ako aj efektívne.
Palivové články
Hydrid horečnatý môže byť implementovaný do výroby moderných palivových článkov a tiež do výroby batérií a skladovania energie.
Doprava a energia
Počas posledných desaťročí sa uvažovalo o použití vodíka ako zdroja energie. Implantácia vodíka ako paliva si vyžaduje nájdenie bezpečných a reverzibilných skladovacích systémov s vysokými objemovými kapacitami (množstvo vodíka na jednotku objemu) a gravimetrickým (množstvo vodíka na jednotku hmotnosti)..
alkylácia
Alkylácia (pridanie CH alkylových skupín3R) organických zlúčenín v bázickom médiu, kde je prítomná skupina -OH pri nízkych koncentráciách a teplotách vyšších ako je teplota topenia hydridu..
V tomto prípade sú vodíky prítomné v hydride horečnatom (MgH)2), spoja -OH skupiny tvoriace vodu. Voľný horčík môže prijímať halogén, ktorý často sprevádza alkylovú molekulu, ktorá sa má viazať na uhľovodíkový reťazec.
riziká
Reakcia s vodou
Ako už bolo spomenuté, hydrid horečnatý je látka, ktorá reaguje veľmi ľahko a prudko s vodou a vykazuje schopnosť explodovať pri vyšších koncentráciách..
K tomu dochádza preto, že jeho exotermická reakcia vytvára dostatok tepla na zapálenie plynného vodíka uvoľneného pri rozkladnej reakcii, čo vedie k skôr nebezpečnej reťazovej reakcii..
Je pyroforický
Hydrid horečnatý je tiež pyroforický, čo znamená, že sa môže spontánne vznietiť v prítomnosti vlhkého vzduchu a vytvára oxid horečnatý a vodu..
Vdychovanie sa neodporúča v pevnom skupenstve alebo v kontakte s jeho výparmi: látka v jej prirodzenom stave a jej produkty rozkladu môžu spôsobiť vážne zranenia alebo dokonca smrť..
Môže vytvárať korozívne roztoky v kontakte s vodou a ich kontamináciu. Kontakt s pokožkou a očami sa neodporúča a tiež spôsobuje podráždenie slizníc.
Nebolo preukázané, že hydrid horčíka môže vyvolať chronické účinky na zdravie, ako sú rakovina, reprodukčné poruchy alebo iné fyzické alebo duševné následky, ale pri manipulácii s ním sa odporúča použitie ochranných prostriedkov (najmä respirátorov alebo masiek, pre jeho použitie v prípade, že sa jedná o \ t charakter jemného prachu).
Pri práci s touto látkou musí byť vlhkosť vzduchu udržiavaná na nízkej úrovni, uhasiť všetky zdroje vznietenia a prepravovať ju v sudoch alebo iných kontajnerových kontajneroch..
Vždy by ste sa mali vyhýbať práci s veľkými koncentráciami tejto látky, ak sa jej dá vyhnúť, pretože sa výrazne znižuje možnosť výbuchu.
Ak dôjde k rozliatiu hydridu horečnatého, pracovný priestor by mal byť izolovaný a prach zachytený vysávačom. Nikdy by ste nemali používať metódu suchého zametania; zvyšuje šance reakcie s hydridom.
referencie
- Zumdahl, S. S. (1998). Encyklopédia Britannica. Prevzaté z britannica.com.
- PubChem. (2005). PubChem Otvorená databáza chémie. Prevzaté z pubchem.ncbi.nlm.nih.gov.
- Safe Hydrogen, L. (2006). Kongres Green Car. Prevzaté z greencarcongress.com.
- Chemikálie, C. (n.d.). Cameo Chemicals. Prevzaté z cameochemicals.noaa.gov.
- Services, N. J. (1987). Ministerstvo zdravotníctva a senior služieb New Jersey. Prevzaté z nj.gov.


