Vlastnosti hydridu vápenatého (CaH2), reaktivity a použitia
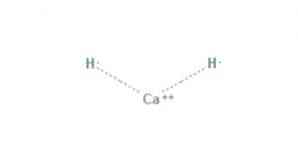
hydrid vápenatý "Chemická zlúčenina vzorca CaH2" je chemická zlúčenina vzorca CaH2, ktorá z nej robí hydrid alkalických zemín. Táto chemická zlúčenina má dve iónové väzby medzi vápnikom a dvoma hydridovými iónmi, ako je znázornené na obr.
Je to fyziologický roztok, čo znamená, že jeho štruktúra je podobná soli. Jeho kryštalická štruktúra je rovnaká ako štruktúra chloridu olovnatého (minerál Cotunnite), ako je znázornené na obr.

Všetky alkalické kovy a kovy alkalických zemín tvoria hydridové soli. V chémii je hydridom anión vodíka, H- alebo častejšie zlúčenina, v ktorej jedno alebo viac vodíkových centier má nukleofilné, redukčné alebo bázické vlastnosti..
V zlúčeninách, ktoré sú považované za hydridy, je atóm vodíka pripojený k viac elektropozitívnemu prvku alebo skupine.
Môže sa vyrábať reakciou vápnika a vodíka pri teplote medzi 300 a 400 ° C. Ďalší spôsob prípravy hydridu vápenatého je zahriatie chloridu vápenatého spolu s vodíkom a sodíkovým kovom. Reakcia sa deje nasledovne:
CaCl2 + H2 + 2Na → CaH2 + 2NaCl
V tejto reakcii vápnik (Ca) a vodík (H) vytvárajú molekulu hydridu vápenatého, zatiaľ čo atómy sodíka spolu s chlórom vytvárajú molekuly chloridu sodného (NaCl)..
Hydrid vápenatý môže byť tiež vyrobený redukciou oxidu vápenatého (CaO) horčíkom (Mg). Reakcia sa uskutočňuje v prítomnosti vodíka. Táto reakcia tiež produkuje oxid horečnatý (MgO). Nižšie je uvedený vzorec pre túto chemickú reakciu:
CaO + Mg + H2 - CaH2 + MgO
index
- 1 Fyzikálne a chemické vlastnosti hydridu vápenatého
- 2 Reaktivita a nebezpečenstvá
- 3 Manipulácia a skladovanie
- 4 Použitie a aplikácie
- 4.1 Vysúšadlo
- 4.2 Výroba vodíka
- 4.3 Redukčné činidlo
- 5 Nevýhodou pri použití hydridu vápenatého
- 6 Referencie
Fyzikálne a chemické vlastnosti hydridu vápenatého
Hydrid vápenatý je súbor kryštálov s bielou ortorombickou štruktúrou, keď je čistý. Vo všeobecnosti je zriedkavé nájsť ju v tejto forme, takže má zvyčajne sivastý odtieň. Chýba mu charakteristická vôňa. Jeho vzhľad je znázornený na obrázku 3 (Royal Society of Chemistry, 2015).

Má molekulovú hmotnosť 42,094 g / mol, má teplotu topenia 816 ° C a hustotu 1,70 g / ml. Ak sa rozpúšťa vo vode, reaguje prudko produkujúc vodík. Reaguje aj s alkoholom (Národné centrum pre biotechnologické informácie, S.F.).
Reaktivita a nebezpečenstvá
Hydrid vápenatý je stabilná chemikália, hoci je vysoko reaktívna voči vode alebo vlhkosti. Pri kontakte s vodou uvoľňuje horľavé vodíkové plyny, ktoré sa môžu samovoľne vznietiť.
Považuje sa za výbušnú zlúčeninu. Keď sa zahrieva v reakcii s tetrahydrofuránom, môže spôsobiť výbuch. Keď sa zmieša s chlorečnanom, chlórnanom, bromičnanom, chloristanom draselným, stáva sa citlivým na teplo, trenie a stáva sa výbušným (hydrid vápenatý 7789-78-8, 2016).
Keď je fluorid strieborný rozdrvený s hydridom vápenatým, hmota sa stáva žeravúcou. Silné zahrievanie hydridu chlórom, brómom alebo jódom vedie k žiareniu.
Zmesi hydridu s rôznymi bromičnanmi, napríklad bromičnan bárnatý alebo chlorečnany, napríklad chlorečnan bárnatý a chloristany, ako je chloristan draselný, explodujú pri triturácii. CaH2 reaguje s fluoridom strieborným, ak je vystavený treniu.
S touto zlúčeninou sa musí manipulovať v inertnej atmosfére. Ak sa s nimi nebude zaobchádzať správne, môže to vážne ohroziť zdravie a bezpečnosť laboratórnych pracovníkov, záchranárov a manipulátorov s chemickým odpadom (centrum UC pre bezpečnosť laboratórií, 2013)..
Mimoriadne nebezpečný v prípade kontaktu s pokožkou alebo očami, pretože je dráždivý. Veľmi nebezpečný v prípade kontaktu s pokožkou, pretože môže byť žieravý.
Je tiež nebezpečný v prípade požitia a vdýchnutia. Množstvo poškodenia tkaniva závisí od dĺžky kontaktu. Kontakt s očami môže spôsobiť poškodenie rohovky alebo slepotu.
Kontakt s pokožkou môže spôsobiť zápal a pľuzgiere. Vdýchnutie prachu spôsobí podráždenie gastrointestinálneho alebo respiračného traktu, charakterizované pálením, kýchaním a kašľom..
Ťažká nadmerná expozícia môže spôsobiť poškodenie pľúc, zadusenie, bezvedomie a dokonca smrť. Zápal oka sa vyznačuje začervenaním, podráždením a svrbením. Zápal kože sa vyznačuje svrbením, olupovaním, začervenaním alebo občasnými pľuzgiermi.
Opakovaná expozícia očí na nízku úroveň môže spôsobiť podráždenie očí. Opakovaná expozícia pokožky môže spôsobiť lokálnu deštrukciu kože alebo dermatitídu.
Opakované vdychovanie prachu môže spôsobiť rôzny stupeň podráždenia dýchacích ciest alebo poškodenia pľúc. Opakované alebo dlhotrvajúce vdychovanie prachu môže spôsobiť chronické podráždenie dýchacích ciest (Karta bezpečnostných údajov materiálu Hydrid vápenatý MSDS, 2005).
V prípade kontaktu s očami je potrebné ich ihneď vyplachovať veľkým množstvom vody po dobu najmenej 15 minút, občas nadvihnúť horné a dolné viečka..
Pri kontakte s pokožkou je potrebné ju ihneď vyplachovať veľkým množstvom vody po dobu najmenej 15 minút a odstrániť kontaminovaný odev a obuv.
V prípade požitia sa nemá vyvolať vracanie. Malo by sa nazvať centrum na kontrolu jedu. Odporúča sa opustiť výstavné miesto a okamžite sa presunúť do exteriéru.
V prípade vdýchnutia, ak je dýchanie ťažké, je potrebné dodávať kyslík. Dýchanie z úst do úst by sa nemalo podať, ak obeť prehltla alebo vdýchla látku.
Umelé dýchanie by malo byť vyvolané pomocou vreckovej masky vybavenej jednosmerným ventilom alebo iným vhodným respiračným zdravotníckym prístrojom. Vo všetkých prípadoch je potrebné okamžite vyhľadať lekársku pomoc.
Manipulácia a skladovanie
Látka sa musí uchovávať v suchom obale mimo dosahu tepla. Skladujte mimo dosahu zdrojov zapálenia. Nevdychujte prach. Do tohto výrobku by sa nemala pridávať žiadna voda
V prípade nedostatočného vetrania používajte vhodné respirátory, napr. Masku filtra. V prípade expozície by ste mali čo najviac vyhľadať lekársku pomoc a ukázať etiketu. Zabráňte kontaktu s pokožkou a očami.
Horľavé materiály by sa vo všeobecnosti mali skladovať v samostatnej bezpečnostnej skrini alebo skladovacej miestnosti. Uchovávajte nádobu tesne uzavretú.
Uchovávajte na chladnom a dobre vetranom mieste. Všetky zariadenia obsahujúce materiál, ktorý zabráni vzniku elektrických iskier, musia byť uzemnené. Nádoba sa musí uchovávať v suchu a na chladnom mieste.
Je to nehorľavý materiál. Hasiči však musia nosiť vhodné vybavenie pri hasení požiaru okolo tejto chemickej zlúčeniny.
Nikdy sa neodporúča používať vodu na hasenie požiaru v okolí hydridu vápenatého. Na tento účel sa môže použiť suchý piesok, ako aj zlúčeniny, ako je chlorid sodný a uhličitan sodný.
Aby sa odstránil odpad z hydridu vápenatého, musí sa rozložiť pridaním 25 ml metanolu na každý gram hydridu v atmosfére dusíka za miešania..
Akonáhle je reakcia ukončená, pridá sa do vodného roztoku metoxidu vápenatého rovnaký objem vody a vypustí sa do kanalizácie s veľkým množstvom vody (National Research Council, 1995)..
Použitie a aplikácie
Sušiace činidlo
Hydrid draselný je relatívne miernym sušidlom. Z tohto dôvodu je použitie tejto zlúčeniny ako sušidla bezpečnejšie v porovnaní s reaktívnejšími činidlami, ako sú napríklad sodno-draselné a sodné kovové zliatiny. Reaguje s vodou nasledujúcim spôsobom:
CaH2 + 2 H20 → Ca (OH) 2 + 2 H2
Produkty hydrolýzy tejto reakcie, vodík (plyn) a Ca (OH) 2 (vodná zmes), sa môžu oddeliť od chemického rozpúšťadla po procese filtrácie, destilácie alebo dekantácie..
Táto chemická zlúčenina je účinným sušidlom pre mnohé bázické rozpúšťadlá, ako sú amíny a pyridín. Niekedy sa používa na predsušenie rozpúšťadiel pred použitím reaktívnejších sušidiel.
Výroba vodíka
V 40. rokoch bola táto zlúčenina dostupná ako zdroj vodíka pod obchodným názvom "Hydrolith".
Dlhodobo sa používa ako zdroj vodíka. Stále sa používa na výrobu čistého vodíka v laboratóriách na rôzne experimenty, pokročilé aplikácie palivových článkov a batérií (American Elements, S.F.)..
Zlúčenina bola široko používaná po celé desaťročia ako bezpečný a pohodlný spôsob nafukovania balónov počasia.
Podobne sa pravidelne používa v laboratóriách na výrobu malých množstiev vysoko čistého vodíka na experimenty. Obsah vlhkosti motorovej nafty sa vypočíta vodíkom vyvinutým po spracovaní CaH2.
Redukčné činidlo
Pri zahrievaní medzi 600 a 1000 stupňami Celzia je možné redukovať oxid zirkoničitý, niób, urán, chróm, titán, vanád a tantal, aby sa pripravil prášok z týchto kovov, aby sa mohol hydrid vápenatý použiť v metalurgii. prachu.
Nasledujúca reakcia ilustruje spôsob, akým hydrid vápenatý pôsobí ako redukčné činidlo:
TiO + 2CaH2 → CaO + H2 + Ti
Nevýhodou pri použití hydridu vápenatého
Táto chemická zlúčenina je často výhodnou voľbou ako sušiace činidlo; Má však aj niektoré nevýhody:
-Sušenie tejto zlúčeniny je pomalé, pretože nie je rozpustné v žiadnom rozpúšťadle, s ktorým nereaguje prudko.
-Táto prášková zlúčenina je nekompatibilná s mnohými rozpúšťadlami. Vaša reakcia s chlórkarbonátmi môže dokonca spôsobiť výbuchy.
-Nemôže byť použitý pre deoxygenujúce rozpúšťadlá, pretože nie je schopný eliminovať rozpustený kyslík.
-Diferenciácia medzi hydridom vápenatým a hydroxidom vápenatým je pomerne náročná vzhľadom na podobné vlastnosti.
referencie
- Americké prvky. (S.F.). hydrid vápenatý. Zdroj: americanelements.com: americanelements.com.
- Hydrid vápenatý 7789-78-8. (2016). Zdroj: Chemicalbook.com: chemicalbook.com.
- hydrid vápenatý. (N. D.). Získané zo študijného odboru chémie: chemistrylearner.com.
- Karta bezpečnostných údajov materiálu Hydrid vápenatý MSDS. (2005, 10. októbra). Zdroj: sciencelab.com: sciencelab.com.
- Národné centrum pre informácie o biotechnológiách. (S.F.). PubChem Compound Database; CID = 105052. Zdroj: pubchem.ncbi.nlm.nih.gov: pubchem.ncbi.nlm.nih.gov.
- národnej rady pre výskum. (1995). Obozretné praktiky v laboratóriu: Manipulácia a likvidácia chemikálií. Washinton: NationalAcademy Press.
- Kráľovská spoločnosť chémie. (2015). hydrid vápenatý ID 94784. Zdroj: chemspider.com: chemspider.com.
- UC centrum pre bezpečnosť laboratórií. (2013, 18. január). štandardný pracovný postup hydrid vápenatý. Zdroj: chemengr.ucsb.edu: chemengr.ucsb.edu.


