Etánová štruktúra, vlastnosti, použitie a riziká
etán "R" je jednoduchý uhľovodík vzorca C2H6 s povahou bezfarebného plynu bez zápachu, ktorý má vysoko hodnotné a diverzifikované použitie pri syntéze etylénu. Okrem toho je to jeden z pozemských plynov, ktorý bol tiež zistený v iných planétach a hviezdnych telách okolo Slnečnej sústavy. V roku 1834 ho objavil vedec Michael Faraday.
Medzi veľkými množstvami organických zlúčenín tvorených atómami uhlíka a vodíka (známymi ako uhľovodíky) sú tie, ktoré sú v plynnom stave pri teplotách a environmentálnych tlakoch, ktoré sa v mnohých priemyselných odvetviach používajú enormne..
Zvyčajne pochádzajú z plynnej zmesi nazývanej "zemný plyn", produkt vysokej hodnoty pre ľudstvo, a okrem iného tvoria metán typu metánu, etán, propán a bután; klasifikované podľa množstva atómov uhlíka vo svojom reťazci.
index
- 1 Chemická štruktúra
- 1.1 Syntéza etánu
- 2 Vlastnosti
- 2.1 Rozpustnosť etánu
- 2.2 Kryštalizácia etánu
- 2.3 Spaľovanie etánu
- 2.4 Etán v atmosfére av nebeských telesách
- 3 Použitie
- 3.1 Výroba etylénu
- 3.2 Školenie základných chemických látok
- 3.3 Chladivo
- 4 Riziká etánu
- 5 Referencie
Chemická štruktúra
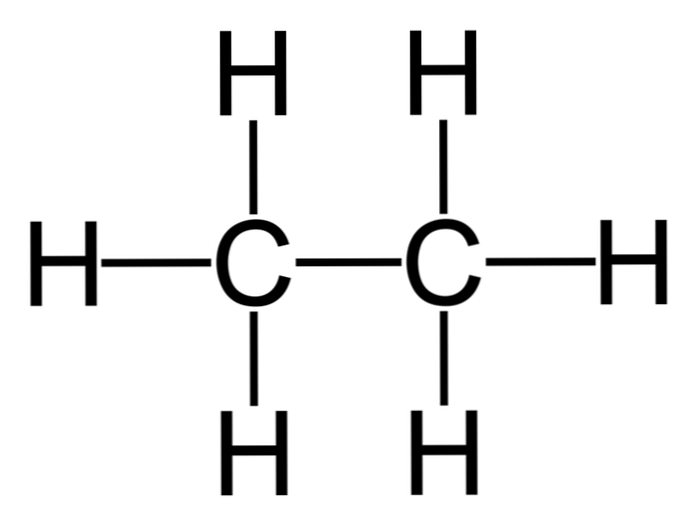
Etán je molekula so vzorcom C2H6, typicky vnímané ako spojenie dvoch metylových skupín (-CH3) za vzniku uhľovodíkov s jednoduchou väzbou uhlík-uhlík. Je to tiež najjednoduchšia organická zlúčenina po metáne, reprezentovaná nasledovne:
H3C-CH3
Atómy uhlíka v tejto molekule majú sp hybridizáciu3, takže molekulárne väzby predstavujú voľnú rotáciu.
Tiež existuje vnútorný jav etánu, ktorý je založený na rotácii molekulárnej štruktúry tej istej a minimálnej energie potrebnej na vytvorenie rotácie väzby 360 stupňov, ktorú vedci nazývali "etánová bariéra"..
Z tohto dôvodu sa môže etán vyskytovať v rôznych konfiguráciách podľa jeho rotácie, aj keď jeho stabilnejšia konformácia existuje tam, kde sú vodíky oproti sebe (ako je znázornené na obrázku)..

Syntéza etánu
Etán sa dá ľahko syntetizovať z elektrolýzy Kolbe, organickej reakcie, v ktorej sa vyskytujú dva kroky: elektrochemická dekarboxylácia (odstránenie karboxylovej skupiny a uvoľnenie oxidu uhličitého) dvoch karboxylových kyselín a kombinácia produktov medziprodukty za vzniku kovalentnej väzby.
Podobne elektrolýza kyseliny octovej vedie k tvorbe etánu a oxidu uhličitého a táto reakcia sa používa na syntézu prvých.
Oxidácia anhydridu kyseliny octovej pôsobením peroxidov, koncept podobný tomu, ktorý má Kolbeova elektrolýza, tiež vedie k tvorbe etánu.
Rovnakým spôsobom môže byť účinne oddelený od zemného plynu a metánu procesom skvapalňovania, pričom sa používajú kryogénne systémy na zachytenie tohto plynu a jeho oddelenie od zmesí s inými plynmi..
Pre túto úlohu je výhodný proces turboexpanzie: plynná zmes prechádza cez turbínu, čím sa vytvára jej expanzia, až kým teplota neklesne pod -100 ° C..
Už v tomto bode môžu byť zložky zmesi diferencované tak, že kvapalný etán bude oddelený od plynného metánu a iných druhov, ktoré sa používajú pri destilácii..
vlastnosti
Etán sa vyskytuje v prírode ako bezfarebný a bezfarebný plyn pri štandardných tlakoch a teplotách (1 atm a 25 ° C). Má teplotu varu -88,5 ° C a teplotu topenia -182,8 ° C. Okrem toho nie je ovplyvnený pôsobením silných kyselín alebo zásad.
Rozpustnosť etanolu
Molekuly etánu sú symetrické a majú slabé príťažlivé sily, ktoré ich držia pohromade, nazývané sily rozptylu.
Keď sa etán pokúsi rozpustiť vo vode, príťažlivé sily vytvorené medzi plynom a kvapalinou sú veľmi slabé, takže je veľmi ťažké spojiť etán s molekulami vody..
Z tohto dôvodu je rozpustnosť etánu značne nízka, keď sa systémový tlak mierne zvyšuje.
Kryštalizácia etánu
Etán môže byť stuhnutý, čo vedie k tvorbe nestabilných kryštálov etánu s kubickou kryštalickou štruktúrou.
Pri poklese teploty nad -183,2 ° C sa táto štruktúra stáva monoklinickou, čo zvyšuje stabilitu jej molekuly.
Etánové spaľovanie
Tento uhľovodík, aj keď nie je široko používaný ako palivo, môže byť použitý v procesoch spaľovania na výrobu oxidu uhličitého, vody a tepla, ktorý je znázornený takto:
2C2H6 + 7o2 → 4CO2 + 6H20 + 3120 kJ
Je tiež možné spáliť túto molekulu bez prebytku kyslíka, ktorý je známy ako "nedokonalého spaľovania", a vedie k tvorbe amorfného uhlíka a oxidu uhoľnatého v nežiaduce reakciu ako vstup kyslíka :
2C2H6 + 3O2 → 4C + 6H2O + Teplo
2C2H6 + 4O2 → 2C + 2CO + 6H2O + Teplo
2C2H6 + 5O2 → 4CO + 6H2O + Teplo
V tejto oblasti dochádza k spaľovaniu radom radikálových reakcií, ktoré sú očíslované v stovkách rôznych reakcií. Pri neúplných spaľovacích reakciách sa môžu vytvoriť napríklad zlúčeniny, ako je formaldehyd, acetaldehyd, metán, metanol a etanol..
To bude závisieť od podmienok, za ktorých sa reakcia vyskytuje a od reakcií voľných radikálov. Etylén sa môže vytvoriť aj pri vysokých teplotách (600-900 ° C), čo je výrobok, ktorý je priemyselom veľmi žiadaný.
Etán v atmosfére a nebeské telá
Etán je prítomný v atmosfére planéty Zem v stopách a je podozrenie, že ľudskej bytosti sa podarilo zdvojnásobiť túto koncentráciu, odkedy začal praktizovať priemyselné aktivity..
Vedci sa domnievajú, že veľká časť súčasnej prítomnosti etánu v atmosfére je spôsobená spaľovaním fosílnych palív, hoci globálne emisie etánu sa znížili takmer o polovicu, pretože sa zlepšili technológie výroby bridlicového plynu. zdroj zemného plynu).
Tento druh je tiež prirodzene produkovaný pôsobením slnečných lúčov na atmosférický metán, ktorý rekombinuje a tvorí molekulu etánu.
Etán existuje v tekutom stave na povrchu Titanu, jedného z mesiacov Saturna. Vyskytuje sa vo väčšom množstve v rieke Vid Flumina, ktorá prúdi viac ako 400 kilometrov smerom k jednému z morí. To bola tiež dokázaná táto zlúčenina na kométy, a na povrchu Pluto.
aplikácie
Výroba etylénu
Použitie etánu je založené hlavne na výrobe etylénu, najpoužívanejšieho organického produktu vo svetovej výrobe, prostredníctvom procesu známeho ako krakovanie parou..
Tento proces pozostáva z privádzania privádzaného etánu zriedeného parou do pece, pričom sa rýchlo zahrieva bez kyslíka.
Reakcia prebieha pri extrémne vysokej teplote (medzi 850 ° C a 900 ° C), ale doba zdržania (čas strávený etánom vo vnútri pece) musí byť krátka, aby bola reakcia účinná. Pri vyšších teplotách sa vytvára viac etylénu.
Školenie základných chemických látok
Etán bol tiež študovaný ako hlavná zložka pri tvorbe základných chemikálií. Jedným zo spôsobov navrhnutých na získanie vinylchloridu (zložka PVC) je oxidačná chlorácia, ktorá nahrádza menej nákladné a komplikovanejšie látky..
osviežujúci
Nakoniec sa etán používa ako chladivo v bežných kryogénnych systémoch, čo tiež ukazuje schopnosť zmraziť malé vzorky v laboratóriu na analýzu..
Je to veľmi dobrá náhrada vody, ktorá trvá dlhšie, kým sa chladné vzorky ochladia, a môže tiež generovať škodlivé ľadové kryštály.
Etické riziká
-Etán má schopnosť vznietiť sa, najmä keď sa viaže vzduchom. Pri percentách 3,0 až 12,5% objemu etánu vo vzduchu sa môže vytvoriť výbušná zmes.
-Môže obmedziť kyslík vo vzduchu, v ktorom sa nachádza, a preto predstavuje rizikový faktor udusenia ľudí a zvierat, ktoré sú prítomné a vystavené..
-Etán v zmrazenej tekutej forme môže vážne spáliť pokožku, ak sa s ňou dostane do priameho kontaktu, a tiež pôsobí ako kryogénne médium pre akýkoľvek predmet, ktorý sa dotýka, a zmrazuje ho v okamihu..
-Výpary kvapalného etánu sú ťažšie ako vzduch a sú koncentrované na zemi, čo môže predstavovať riziko vznietenia, ktoré môže spôsobiť reťazovú reakciu..
-Požitie etánu môže spôsobiť nevoľnosť, vracanie a vnútorné krvácanie. Inhalácia, okrem udusenia, spôsobuje bolesti hlavy, zmätenosť a výkyvy nálady. Smrť spôsobená zástavou srdca je možná pri vysokých expozíciách.
-Predstavuje skleníkový plyn, ktorý spolu s metánom a oxidom uhličitým prispieva ku globálnemu otepľovaniu a klimatickým zmenám spôsobeným znečistením ľudí. Našťastie je menej bohatý a trvanlivý ako metán a absorbuje menej žiarenia ako toto.
referencie
- Britannica, E. (s.f.). Ethan. Získané z britannica.com
- Nes, G.V. (s.f.). Jednotlivé kryštálové štruktúry a distribúcie elektrónovej hustoty etánu, etylénu a acetylénu. Získané z rug.nl
- Sites, G. (s.f.). Etán: Zdroje a výlevky. Zdroj: site.google.com
- SoftSchools. (N. D.). Etánový vzorec. Obnovené z softschools.com
- Wikipedia. (N. D.). Ethan. Zdroj: en.wikipedia.org


