Vyvažovanie metód a príkladov chemických rovníc
vyváženie chemických rovníc znamená, že všetky prvky prítomné v uvedenej rovnici majú rovnaký počet atómov na každej strane. Na dosiahnutie tohto cieľa je potrebné použiť metódy vyvažovania na priradenie stechiometrických koeficientov vhodných pre každý druh prítomný v reakcii..
Chemická rovnica je reprezentácia, prostredníctvom symbolov, čo sa deje v priebehu chemickej reakcie medzi dvoma alebo viacerými látkami. Reaktanty vzájomne interagujú a v závislosti od reakčných podmienok sa ako produkt získa jedna alebo viac rôznych zlúčenín..
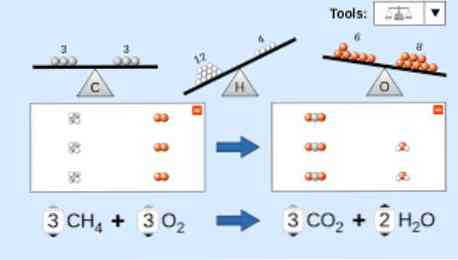
Pri opise chemickej rovnice je potrebné vziať do úvahy nasledovné: Po prvé, reaktantové látky sú napísané na ľavej strane rovnice, po ktorej nasleduje jednosmerná šípka alebo dve proti sebe ležiace horizontálne šípky, v závislosti od typu uskutočňovanej reakcie. mys.
index
- 1 Metódy vyrovnávania chemických rovníc
- 1.1 Bilancia chemických rovníc pokusom a omylom (nazývaná aj inšpekciou alebo skúškou)
- 1.2 Algebraické vyvažovanie chemických rovníc
- 1.3 Valcovanie redox rovníc (metóda ión-elektrón)
- 2 Príklady vyrovnávania chemických rovníc
- 2.1 Prvý príklad
- 2.2 Druhý príklad
- 2.3 Tretí príklad
- 3 Odkazy
Vyvažovacie metódy chemických rovníc
Ak vezmeme do úvahy, že reaktanty a produkty sú známe a že ich vzorce sú správne vyjadrené na strane, ktorá im zodpovedá, postupujeme k vyváženiu rovníc podľa nasledujúcich metód..
Vyvažovanie chemických rovníc pokusom a omylom (nazývané aj kontrolou alebo skúškou)
Je založený na stechiometrii reakcie a snaží sa vyskúšať s rôznymi koeficientmi, aby sa vyrovnala rovnica, pokiaľ sa vyberú najmenšie možné celé čísla, s ktorými sa získa rovnaký počet atómov každého prvku na oboch stranách. reakcie.
Koeficient reaktantu alebo produktu je číslo, ktoré predchádza jeho vzorcu, a je to jediné číslo, ktoré možno zmeniť pri vyvážení rovnice, pretože zmena dolných indexov vzorcov by zmenila identitu zlúčeniny. predmetné.
Počet a porovnanie
Potom, čo sme identifikovali každý prvok reakcie a umiestnili ho na správnu stranu, budeme počítať a porovnávať počet atómov každého prvku prítomného v rovnici a určovať tie, ktoré musia byť vyvážené..
Potom pokračujeme s vyvážením každého prvku (jeden po druhom), umiestnením celých koeficientov pred každý vzorec, ktorý obsahuje nevyvážené prvky. Kovové prvky sú zvyčajne vyvážené najprv, potom nekovové prvky a nakoniec atómy kyslíka a vodíka.
Týmto spôsobom každý koeficient vynásobí všetky atómy predchádzajúceho vzorca; tak zatiaľ čo rovnováha medzi prvkom, ostatné môžu nevyvážiť, ale to je opravené, pretože reakcia je vyvážená.
Nakoniec, posledný počet je potvrdený tým, že celá rovnica je správne vyvážená, to znamená, že dodržiava zákon o ochrane hmoty..
Algebraické vyvažovanie chemických rovníc
Na použitie tejto metódy je zavedený postup na spracovanie koeficientov chemických rovníc ako neznámych systému, ktorý musí byť vyriešený..
Po prvé, špecifický prvok reakcie sa berie ako referencia a koeficienty sa umiestnia ako písmená (a, b, c, d ...), ktoré predstavujú neznáme, podľa existujúcich atómov tohto prvku v každej molekule (ak druh neobsahuje tento prvok je umiestnený "0").
Po získaní tejto prvej rovnice sa určia rovnice pre ďalšie prvky prítomné v reakcii; bude existovať toľko rovníc, koľko sú prvky uvedenej reakcie.
Nakoniec, neznáme sú určené jednou z algebraických metód redukcie, ekvalizácie alebo substitúcie a sú získané koeficienty, ktoré majú za následok správne vyváženú rovnicu.
Vyvažovacie redox rovnice (metóda ión-elektrón)
Najprv sa do svojej iónovej formy umiestni všeobecná (nevyvážená) reakcia. Potom je táto rovnica rozdelená na dve polovičné reakcie, oxidáciu a redukciu, pričom každá z nich je vyvážená podľa počtu atómov, ich typu a nábojov z týchto atómov..
Napríklad pre reakcie, ktoré sa vyskytujú v kyslom prostredí, sa pridajú molekuly H.2Alebo na vyrovnanie atómov kyslíka a pridanie H+ na vyrovnanie atómov vodíka.
Naproti tomu v alkalickom médiu sa pridá rovnaký počet iónov OH- na oboch stranách rovnice pre každý H ión+, a kde vznikajú ióny H+ a OH- spájajú sa a tvoria molekuly H2O.
Pridajte elektróny
Potom musíte pridať toľko elektrónov, koľko je potrebné na vyváženie nábojov po vyvážení hmoty v každej polovičnej reakcii.
Následne po zvinutí každej polovičnej reakcie sa tieto pridajú a kulminujú vyvažovaním konečnej rovnice pokusom a chybou. V prípade, že existuje rozdiel v počte elektrónov dvoch polovičných reakcií, jeden alebo obidva musia byť vynásobené koeficientom rovným tomuto číslu..
Nakoniec je potrebné potvrdiť, že rovnica zahŕňa rovnaký počet atómov a rovnaký typ atómov, okrem toho, že majú rovnaké náboje na oboch stranách globálnej rovnice..
Príklady vyrovnávania chemických rovníc
Prvý príklad
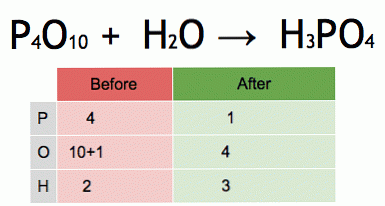
Toto je animácia vyváženej chemickej rovnice. Oxid fosforečný a voda sa prevedú na kyselinu fosforečnú.
P4O10 + 6 H20 → 4 H3PO4 (-177 kJ).
Druhý príklad
Máte spaľovaciu reakciu etánu (nevyvážené).
C2H6 + O2 → CO2 + H2O
Použitím metódy pokusu a omylu na jej vyrovnanie sa zistilo, že žiadny z prvkov nemá na oboch stranách rovnice rovnaký počet atómov. Začína teda bilanciou uhlíka a pridáva dva ako stechiometrický koeficient, ktorý ho sprevádza na strane produktov..
C2H6 + O2 → 2CO2 + H2O
Uhlík bol vyvážený na oboch stranách, takže pokračujeme v vyvážení vodíka pridaním troch do molekuly vody.
C2H6 + O2 → 2CO2 + 3H2O
Nakoniec, keďže na pravej strane rovnice je sedem atómov kyslíka a je to posledný prvok, ktorý má byť ešte vyvážený, zlomkové číslo 7/2 je umiestnené pred molekulou kyslíka (hoci sú všeobecne preferované celé koeficienty).
C2H6 + 7 / 2O2 → 2CO2 + 3H2O
Potom overte, že na každej strane rovnice je rovnaký počet atómov uhlíka (2), vodíka (6) a kyslíka (7)..
Tretí príklad
Oxidácia železa dvojchrómanovými iónmi sa vyskytuje v kyslom prostredí (nevyvážené a vo svojej iónovej forme)..
viera2+ + Cr2O72- → Viera3+ + Cr3+
Využitím iónovo-elektrónovej metódy na jej vyváženie je rozdelená na dve polovičné reakcie.
Oxidácia: Viera2+ → Viera3+
Zníženie: Cr2O72- → Cr3+
Keďže atómy železa sú už vyvážené (1: 1), na strane produktov sa pridáva elektrón na vyrovnanie náboja.
viera2+ → Viera3+ + a-
Atómy Cr sú teraz vyvážené a pridávajú dve na pravej strane rovnice. Keď sa reakcia uskutoční v kyslom prostredí, pridá sa sedem molekúl H.2Alebo na strane produktov na vyrovnanie atómov kyslíka.
Cr2O72- → 2Cr3+ + 7H2O
Na vyváženie atómov H sa pridá štrnásť iónov H+ na strane reaktantov a po vyrovnaní materiálu sú náboje vyvážené pridaním šiestich elektrónov na tej istej strane.
Cr2O72- +14H+ + 6e- → 2Cr3+ + 7H2O
Nakoniec sa pridajú obidve polovičné reakcie, ale keďže v oxidačnej reakcii je len jeden elektrón, všetko sa musí vynásobiť šiestimi..
6Fe2+ + Cr2O72- +14H+ + 6e- → Viera3+ + 2ch3+ + 7H2O + 6e-
Nakoniec, elektróny musia byť eliminované na oboch stranách globálnej iónovej rovnice, overujúc, že ich náboj a záležitosť sú správne vyvážené..
referencie
- Chang, R. (2007). Chémia. (9. vydanie). McGraw-Hill.
- Hein, M., a Arena, S. (2010). Základy vysokoškolskej chémie, alternatíva. Zdroj: books.google.co.ve
- Tuli, G. D. a Soni, P. L. (2016). Jazyk chémie alebo chemické rovnice. Zdroj: books.google.co.ve
- Speedy Publishing (2015). Chemické rovnice a odpovede (Sprievodcovia rýchlym štúdiom). Zdroj: books.google.co.ve


