Atómový model Dalton Postulátov
Daltonov atómový model alebo Daltonova atómová teória, Bol to návrh predložený v rokoch 1803 až 1807 anglickým chemikom a matematikom Johnom Daltonom. Išlo o prvý návrh koncepčnej organizácie týkajúcej sa štruktúry a fungovania atómov.
Daltonov model je tiež známy ako sférický model, pretože navrhuje, že atóm je nedeliteľná, pevná a kompaktná guľa. Vďaka tomuto modelu bolo oveľa ľahšie poskytnúť vysvetlenie o chémii zvyšku sveta a bolo základom mnohých inovatívnych výskumných projektov, ktoré nasledovali. Mohli by sme vysvetliť, prečo látky v niektorých štátoch reagovali.
Podľa Daltona, hmota bola zložená z minimálnej jednotky nazývanej atóm, ktorý nemohol byť zničený alebo rozdelený v žiadnom prípade. Táto jednotka, pôvodne navrhovaná demokratom a jeho mentorom Leucipo, bola základom Daltonovho výskumu a tvorby jeho atómového modelu..
S touto atómovou teóriou sa John Dalton pokúsil prijať myšlienky gréckych filozofov o existencii atómu (atómová teória vesmíru), ale ako platforma použil rôzne laboratórne experimenty, ktoré mu umožnili demonštrovať svoje myšlienky..
index
- 1 Postuláty Daltonovho atómového modelu
- 1.1 Postulát 1
- 1.2 Postulát 2
- 1.3 Postulát 3
- 1.4 Postulát 4
- 1.5 Postulát 5
- 1.6 Postulát 6
- 2 Chyby Atómového modelu Daltona
- 2.1 Vzorec vody
- 2.2 Zloženie atómov
- 3 Závery
- 4 Daltonove hlavné príspevky
- 4.1 Predchodca atómových teórií
- 4.2 Položil základy modernej chémie
- 4.3 Najprv zverejniť tabuľku chemických váh
- 4.4 Uveďte názov farebnej slepoty
- 5 Články záujmu
- 6 Referencie
Postuláty atómového modelu Dalton
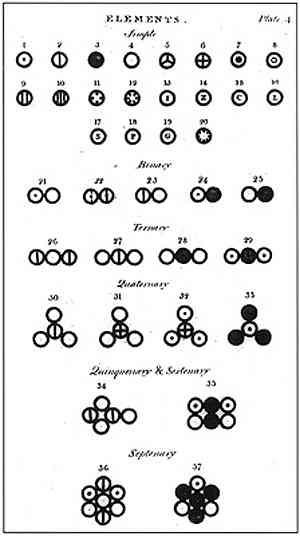
Dalton formuloval svoj atómový model so 6 postulátmi, v ktorých vysvetľuje, ako založil svoje štúdie a ako ich vykonával.
Postulát 1

Vo vyššie uvedenom obrázku je znázornený súhrn Daltonovho modelu: atómy by boli malé guľôčky nedeliteľné, nezničiteľné a homogénne.
Daltonov prvý postulát uviedol, že prvky sa skladajú z malých častíc nazývaných atómy, ktoré sa nedajú rozdeliť ani ich nemožno zničiť..
Dalton tiež poznamenal, že tieto častice sa nemôžu zmeniť v žiadnej chemickej reakcii.
Postulát 2

Druhý postulát Daltona zistil, že všetky atómy prítomné v tom istom prvku majú rovnakú hmotnosť ako v iných charakteristikách.
Na druhej strane sa tiež zistilo, že atómy rôznych prvkov majú rozdielnu hmotnosť. Z tohto návrhu vyplynulo poznanie relatívnych atómových hmotností, ktoré boli preukázané pri porovnávaní rôznych prvkov s vodíkom.
Postulát 3

Tretí postulát z Daltonu zistil, že atómy sú nedeliteľné, aj keď sú kombinované v chemických reakciách. Nemôžu byť ani stvorení alebo zničení.
Kombinácia atómov, rovnakých aj odlišných, bude vytvárať zložitejšie zlúčeniny, ale tento proces nezmení skutočnosť, že atóm je minimálnou jednotkou hmoty..
Postulát 4
Štvrtý postulát Daltona zistil, že aj keď sa atómy kombinujú do formy zlúčeniny, vždy budú mať vzťah, ktorý môže byť vyjadrený v jednoduchých a úplných číslach. Táto expresia nebude ukázaná vo frakciách, pretože atómy sú nedeliteľné.
Postulát 5
Daltonov piaty postulát uviedol, že existuje možná kombinácia rôznych atómov v rôznych pomeroch za vzniku viac ako jednej zlúčeniny.
Týmto spôsobom by sa dalo vysvetliť, že z konečného množstva atómov prišli všetky existujúce hmoty vo vesmíre.
Postulát 6
Daltonov šiesty a posledný postulát uviedol, že každá chemická zlúčenina bola vytvorená z kombinácie atómov dvoch alebo viacerých rôznych prvkov.
Chyby Daltonovho atómového modelu
Podobne ako všetky teórie vo svete vedy, išlo o mnohé vyvrátenia vzhladom na model navrhnutý Daltonom, ktorý sa v priebehu rokov preukázal, že zanechal inovatívne myšlienky Daltona..
Vzorec vody
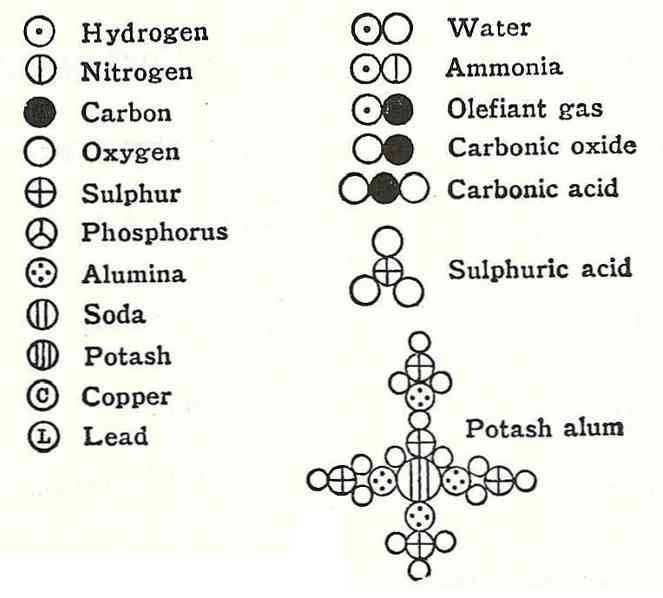
Príkladom toho bol argument Daltona o vzorci vody, ktorý povedal, že sa skladal z vodíka a kyslíka.
Na základe tohto vyhlásenia sa vyskytlo mnoho chýb pri výpočte vzhľadom na hmotnosť a hmotnosť niektorých základných zlúčenín, ktoré boli založené na týchto informáciách.
O niekoľko rokov neskôr európski vedci Gay-Lussac a Alexander von Humbodt túto informáciu vyvrátili a dokázali, že voda sa vlastne skladá z dvoch vodíkov a jedného kyslíka. O 6 rokov neskôr Amadeo Avogadro poukázal na presné zloženie vody a preto je tu zákon Avogadro.
Zloženie atómov
Na druhej strane, v dvadsiatom storočí bolo odhalené skutočné zloženie atómov. V tomto prípade sa ukázalo, že existuje menšia jednotka ako protóny, elektróny a neutróny.
Podobne, existencia rôznych atómových hmotností stanovených v periodickej tabuľke Mendeleev a Meyer, existencia izotopov a špecifickejšie chemické vlastnosti,.
závery
Napriek jeho chybám, príspevky Johna Daltona mali veľký význam vo svete vedy a spôsobili rozruch v jeho čase kvôli veľkému množstvu informácií, ktoré poskytol.
Vaše vedecké príspevky sú stále platné a stále sa študujú.
Atómový model Daltona nebol po celé desaťročia spochybňovaný vzhľadom na jeho význam vo svete vedy a jeho správne vysvetlenie k vyšetrovaniam a hypotézam, ktoré boli v tom čase prezentované v dejinách vedy..
Hlavné príspevky Daltona
Jeho prínos pre svet vedy bol hlavne objasniť a formulovať hypotézy o prírode prostredníctvom kvantitatívnych testov.
Vedec zomrel na srdcový infarkt 27. júla 1884 v Manchestri a krátko potom, čo dostal ocenenie z monarchie.
Prekurzor atómových teórií
John Dalton bol anglický chemik, matematik a chemik. Narodil sa 6. septembra 1766 v Cumberlande vo Veľkej Británii a je známy ako jeden z predchodcov atómových teórií od chvíle, keď predstavil svoj atómový model..
Položil základy modernej chémie
Dalton je známy ako jeden z predchodcov pri vytváraní tabuľky relatívnych váh pre chemické prvky. Táto skutočnosť pomohla položiť základy toho, čo dnes poznáme ako modernú chémiu.
Najprv zverejniť tabuľku chemických váh
Dalton bol prvý vedec, ktorý mal tú česť vydať tabuľku atómových váh, ktorá zahŕňala prvky ako vodík, kyslík, fosfor, uhlík a síra. Vďaka tejto publikácii začal Dalton pracovať a formovať, čo by bol jeho atómový model.
Uveďte názov farebnej slepoty
Treba poznamenať, že Dalton bol jedným z prvých ľudí, ktorí boli zaregistrovaní s vizuálnymi problémami, aby zachytili farby a vďaka nemu je táto podmienka pomenovaná ako farebná slepota.
Články záujmu
Atómový model Schrödingera.
Atómový model Broglieho.
Atómový model Chadwicku.
Atómový model Heisenberga.
Atómový model Perrinu.
Atómový model Thomsona.
Atómový model Dirac Jordan.
Atómový model Democritus.
Atómový model Bohr.
referencie
- Daltonova atómová teória. Získané 24. novembra 2017, z Khanacademy: www.khanacademy.org
- Daltonova atómová teória. Získané 24. novembra 2017, z Indiana University Northwest: iun.edu
- Atómová teória. Získané 24. novembra 2017 od spoločnosti Encyclopædia Britannica: www.britannica.com
- Atómová teória. Zdroj: 24. novembra 2017, z Wikipédie: sk.wikipedia.org
- História atómovej štruktúry. Získané 24. novembra 2017, od spoločnosti Lumen: courses.lumenlearning.com.


